Le type même de publication que VAN DER LA HYENE et Macron veulent censurer

revue par les pairs
Le cancer est une maladie complexe et dynamique. Cette complexité stupéfiante appelle à la prudence lorsqu’on conseille à toutes les personnes atteintes de cancer (ou ayant des antécédents de cancer) de recevoir la série de vaccins primaires contre la COVID-19 ainsi que des doses de rappel supplémentaires. De plus, comme ces patients n’ont pas été inclus dans les essais cliniques pivots, une incertitude considérable demeure quant à l’efficacité, à la sécurité et au risque d’interactions avec les thérapies anticancéreuses du vaccin, ce qui pourrait réduire la valeur et l’innocuité de l’un ou l’autre traitement médical.
Après avoir examiné la littérature disponible, nous sommes particulièrement préoccupés par le fait que certains vaccins contre la COVID-19 puissent générer un milieu pro-tumorigène (c’est-à-dire un environnement spécifique qui pourrait conduire à une transformation néoplasique) qui prédispose certains patients et survivants oncologiques (stables) à la progression du cancer. récidive et/ou métastase. Cette hypothèse est basée sur la plausibilité biologique et la réalisation de l’hypothèse de l’oncogenèse à succès multiples (c’est-à-dire induction de lymphopénie et d’inflammation, régulation négative de l’expression de l’enzyme de conversion de l’angiotensine 2 (ACE2), activation de cascades oncogènes, séquestration de protéines suppressives de tumeur, dérégulation. du système de liaison quadruplex-protéine ARN-G, altération des réponses à l’interféron de type I, désactivation des éléments rétrotransposables, etc.) ainsi que des preuves croissantes et des rapports de sécurité déposés auprès du Vaccine Adverse Effects Report System (VAERS) suggérant que certains patients atteints de cancer ont souffert de la maladie. exacerbation ou récidive après la vaccination contre la COVID-19. À la lumière de ce qui précède et parce que certaines de ces préoccupations (c’est-à-dire l’altération des voies oncogènes, la promotion de cascades inflammatoires et la dérégulation du système rénine-angiotensine) s’appliquent également aux patients cancéreux infectés par le SRAS-CoV-2, nous encourageons les scientifiques et la communauté médicale à évaluer de toute urgence l’impact du COVID-19 et de la vaccination contre le COVID-19 sur la biologie du cancer et les registres des tumeurs, en ajustant les recommandations de santé publique en conséquence.
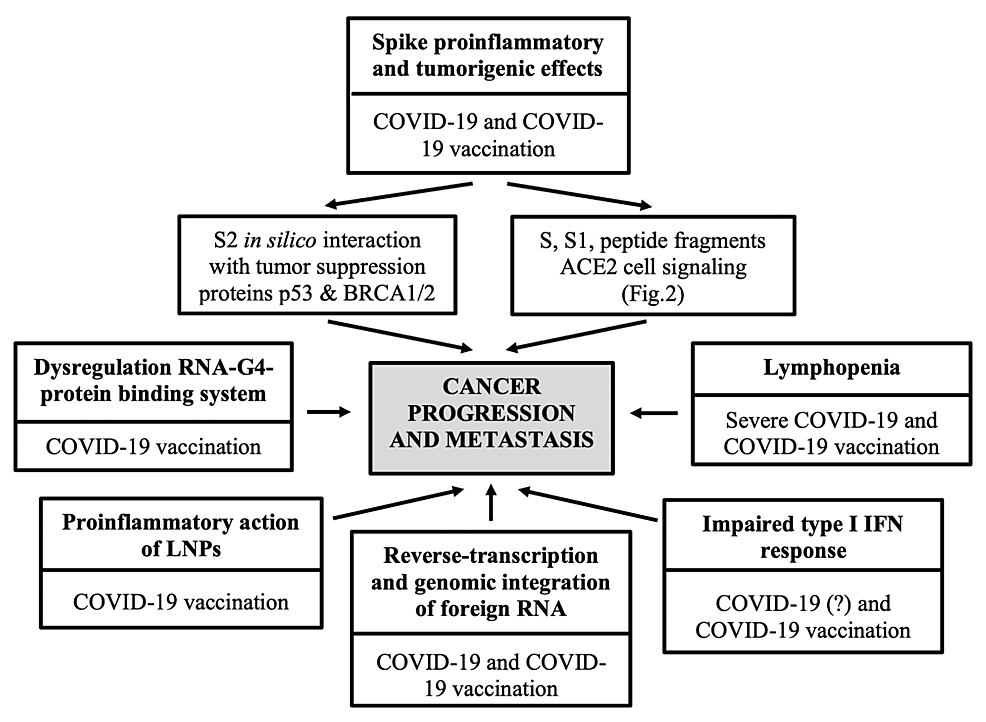
Figure 1 : Mécanismes et voies moléculaires favorisant le cancer potentiellement médiés par le SRAS-CoV-2 et/ou certains vaccins contre la COVID-19
SARS-CoV-2 : coronavirus 2 du syndrome respiratoire aigu sévère, COVID-19 : coronavirus 2019, BRCA1/2 : cancer du sein 1/2, ACE2 : enzyme de conversion de l’angiotensine 2, LNP : nanoparticules lipidiques, ARN : acide ribonucléique, IFN : interféron
De plus, des niveaux élevés de Spike soluble et/ou de ses sous-unités et fragments peptidiques ont été trouvés dans la circulation des vaccinés, où ils persistent pendant des semaines, voire des mois. Il est donc plausible que la distribution soutenue et systémique du pic dans le corps humain (le pic viral n’aura pas, dans la plupart des cas, d’impact sur les tissus et organes autres que les voies respiratoires) puisse favoriser une série d’interactions imprévues avec l’enzyme de conversion de l’angiotensine 2 ( ACE2), le récepteur d’entrée du SRAS-CoV-2, soit sous sa forme soluble circulante, soit exprimé dans des cellules de divers tissus et organes.
Pour les raisons qui précèdent, il est impératif de comprendre les effets du COVID-19 et de la vaccination contre le COVID-19 sur les cellules cancéreuses et leur microenvironnement.
La lymphopénie est une caractéristique de la vaccination contre la COVID-19 sévère et de la vaccination contre la COVID-19
La lymphopénie, une affection définie par un nombre anormalement faible de lymphocytes, est une caractéristique du COVID-19 grave par rapport à une maladie non grave [34-36] . Les causes sous-jacentes possibles de la lymphopénie observée, en particulier la diminution du nombre de lymphocytes T, comprennent la redistribution des lymphocytes T dans les organes infectés, l’épuisement induit par l’activation, l’apoptose et la pyropoptose [37] . Bien que l’épuisement des lymphocytes T soit observé dans d’autres infections virales [38] , il semble être plus rapide, plus profond et plus durable dans le contexte du COVID-19. Une étude récente suggère que la lymphopénie chez les patients atteints d’une forme grave de COVID-19 est susceptible de résulter d’une infection des lymphocytes T par le SRAS-CoV-2 d’une manière indépendante du Spike-ACE2 [39] . De plus, il a été rapporté que l’expression de Spike seule est suffisante pour induire une fusion membranaire rapide pour produire du syncytium, un type de grandes cellules avec plusieurs noyaux négatifs pour les molécules de jonction intercellulaire telles que la E-cadhérine. Les syncytia ont tendance à internaliser les lymphocytes, contribuant ainsi à la perte de lymphocytes chez les patients atteints de COVID-19 [40] .
La lymphopénie a également été associée à la vaccination contre le COVID-19. Les essais cliniques de phase I/II avec les vaccins BNT162b1 (Pfizer/BioNTech) [41] et ChAdOx1 (Oxford/AstraZeneca) [42] ont décrit une diminution dose-dépendante des lymphocytes plasmatiques 6 à 8 jours après la vaccination chez 45 à 46 % des patients. de participants. De manière cohérente, deux prépublications basées sur les programmes de vaccination en Israël (vaccin BNT162b1) [43] et en Angleterre (vaccins BNT162b1 et ChAdOx1) [44] ont signalé une augmentation initiale du risque d’infection jusqu’à neuf jours après la vaccination. Néanmoins, il a été démontré que les lymphocytes T spécifiques aux antigènes viraux du SRAS-CoV-2 augmentent après l’immunisation avec à la fois des vaccins génétiques (c’est-à-dire des lymphocytes T spécifiques de pointe) et des plates-formes traditionnelles telles que le virus de la vaccine modifié multiantigène Ankara (MVA) – basé sur le vaccin COVID-19 COH04S1 (c.-à-d. Cellules T spécifiques de la membrane, des nucléoprotéines et des pointes) [45,46] .
Même si les mécanismes moléculaires qui sont à l’origine de la lymphopénie lors de l’infection au COVID-19 et de la vaccination ne sont pas entièrement compris, la lymphopénie est depuis longtemps associée à une incidence accrue de cancer et à un risque de malignité [47] . Les altérations lymphocytaires sont fréquentes chez les patients atteints de cancer et ont un impact important sur le pronostic et la survie [47,48] . La lymphopénie sévère à cellules T CD4+ est l’une des caractéristiques de l’infection par le virus de l’immunodéficience humaine (VIH). Les personnes atteintes du VIH/SIDA courent un risque plus élevé de développer certains types de tumeurs (c.-à-d. le sarcome de Kaposi) que les personnes non atteintes de la maladie [49-51] . Les lymphocytes T CD8+ jouent un rôle crucial dans la dormance à médiation immunitaire, et leur épuisement libère les freins des DCC, conduisant à une croissance métastatique [52,53] . L’immunosuppression induite par l’anesthésie peut favoriser les rechutes du cancer en fonction de la dose, de la durée et du moment de l’utilisation [54] . L’exposition à des médicaments immunosuppresseurs qui préviennent le rejet d’organe chez les receveurs de greffe d’organe altère la surveillance du cancer et facilite l’action des virus oncogènes, augmentant ainsi le risque de complications néoplasiques après la transplantation [55] . De la même manière, les receveurs de greffe d’organe acceptant un organe provenant d’un donneur survivant du cancer pourraient développer une tumeur maligne parce que l’exposition aux médicaments immunosuppresseurs permet à des métastases latentes cachées (transplantées avec l’organe) de prendre vie [56] . Il convient de noter que 25 % des cancers développés chez des patients ayant subi une transplantation d’organe connaissent une rémission clinique lorsque la dose administrée du médicament immunosuppresseur est considérablement réduite [57] . Il est remarquable que certains types de traitement du cancer, tels que la chimiothérapie, la radiothérapie et la combinaison de chimiothérapie et d’immunothérapie, peuvent également provoquer une lymphopénie sévère, corrélée à une survie réduite [47,58,59] .
Étant donné que la lymphopénie, associée aux facteurs liés à l’inflammation (décrits ci-dessous), contribue à la création d’un microenvironnement favorable à la progression du cancer et/ou au réveil des DCC, une extrême prudence est de mise lorsqu’on recommande la vaccination contre la COVID-19 (jusqu’à cinq doses) [ 8] aux patients oncologiques, notamment ceux sous traitement anticancéreux. Des études approfondies concernant les mécanismes moléculaires qui conduisent à une réduction globale des lymphocytes chez les patients atteints de COVID-19 et chez les vaccinés devraient aider à identifier des stratégies de vaccination améliorées et/ou des interventions alternatives qui préviennent cette anomalie immunologique majeure et ses conséquences.
La glycoprotéine de pointe du SRAS-CoV-2 et sa sous-unité S1 provoquent une signalisation cellulaire in vitro qui pourrait favoriser la tumorigenèse in vivo
Le SRAS-CoV-2 contient une protéine Spike composée de deux sous-unités : S1 et S2. S1 aide le virus à infecter les cellules humaines en se liant à ACE2, une protéine multifonctionnelle principalement exprimée à la surface de nombreuses cellules [60,61] . S2 intervient dans le processus de fusion membranaire [62] . En plus de faciliter l’entrée du SRAS-CoV-2 dans les cellules hôtes, l’interaction entre Spike et AEC2 déclenche une signalisation cellulaire dans les cellules exprimant ACE2 [63] . Les données montrent que, dans les cellules vasculaires pulmonaires et les cellules impliquées dans le développement de l’hypertension artérielle pulmonaire, la sous-unité S1 de Spike seule a activé la MEK, le modulateur de la kinase régulée par le signal extracellulaire (ERK) [ 63] , qui est un mécanisme de transduction du signal pour croissance cellulaire [64] . De plus, Patra et al. [65] ont indiqué que le pic complet, par la régulation négative de l’expression d’ACE2, favorisait une cascade de signalisation médiée par le récepteur de l’angiotensine II de type I (AT1R), induisait les molécules régulatrices de la transcription, le facteur nucléaire-κB (NF-κB) et la protéine activatrice. 1 (AP-1)/c-Fos via l’activation de la protéine kinase activée par un mitogène (MAPK) et une augmentation des taux d’interleukine 6 (IL-6) dans les cellules épithéliales (Figure 2 ) [65] .
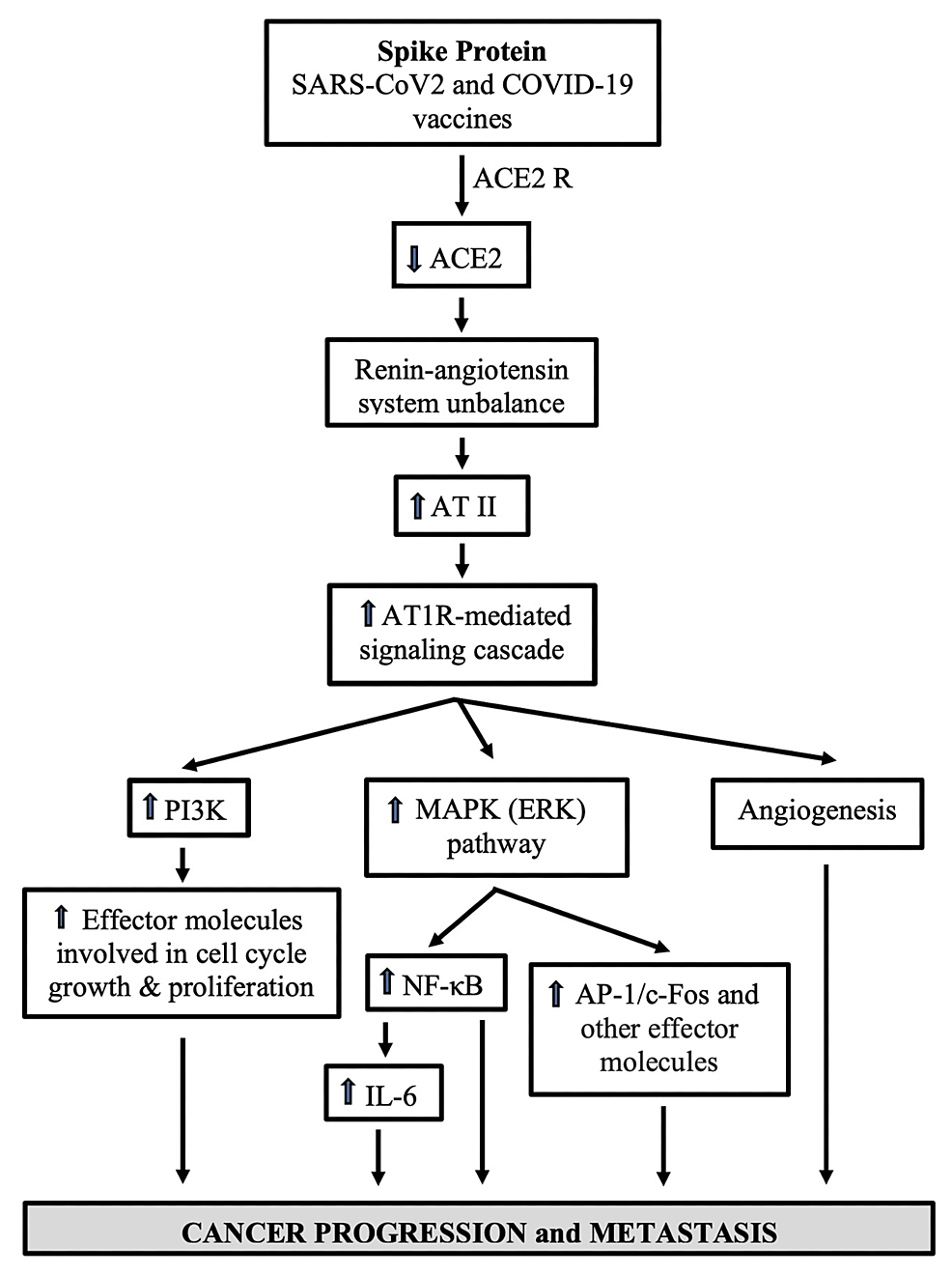
Figure 2 : La régulation négative de l’ACE2 et la signalisation cellulaire induites par les pics pourraient favoriser la progression du cancer chez les patients et les vaccinés atteints du COVID-19
La régulation négative d’ACE2 et sa réponse ultérieure médiée par AT1R ont le potentiel d’encourager la progression du cancer et les métastases grâce à ses activités favorisant la croissance et proangiogéniques.
SARS-CoV-2 : coronavirus 2 du syndrome respiratoire aigu sévère, COVID-19 : coronavirus 2019, ACE2 R : enzyme de conversion de l’angiotensine 2 agissant comme récepteur d’entrée du SARS-CoV-2, ACE2 : enzyme de conversion de l’angiotensine 2, AT II : angiotensine II, AT1R : récepteur de l’angiotensine II type 1, PI3K : phosphatidylinositol 3-kinase, MAPK : protéine kinase activée par un mitogène, ERK : kinase régulée par le signal extracellulaire, NF-κB : facteur nucléaire-κB, IL-6 : interleukine 6 , AP-1 : protéine activatrice 1
L’activation de NF-κB dans les cellules cancéreuses favorise la prolifération, la chimiorésistance et l’invasion, tandis que dans le microenvironnement tumoral, elle stimule l’angiogenèse et la suppression immunitaire, soutenant collectivement le processus métastatique [66] . La cascade de signalisation Ras/Raf/MEK/ERK (MAPK) est fréquemment impliquée dans la malignité [67] . En effet, plus de 30 % de tous les cancers humains sont provoqués par les gènes Ras [68-75] . Des niveaux élevés d’IL-6 sont corrélés à des taux accrus de rechute tumorale dans le cancer du sein et le cancer de la tête et du cou [76,77] . En revanche, l’inhibition de la signalisation IL-6/transducteur de signal et activateur de transcription 3 (STAT3) a réduit la récidive du cancer dans les modèles précliniques de carcinome du sein, de la tête et du cou et du carcinome hépatocellulaire [78-80] . La cascade de signalisation médiée par AT1R active également la phosphatidylinositol 3-kinase (PI3K), un composant de l’une des voies intracellulaires les plus importantes (PI3K/AKT/mTOR) et un régulateur principal du cancer [67,81] . La suractivation de cette voie est présente dans de nombreuses tumeurs malignes humaines et a été impliquée dans la progression du cancer. De manière cohérente, l’utilisation d’inhibiteurs de PIK3 est une approche courante dans le traitement des tumeurs [82] .
Considérant que les cellules humaines répondent de manière sensible au pic et/ou à sa sous-unité S1 pour déclencher la signalisation cellulaire ACE2 et que l’ACE2 exerce de multiples effets antitumoraux et anti-invasifs, y compris l’inhibition de l’angiogenèse et des métastases du cancer, le pic prolongé (voire transitoire) La régulation négative (ou la perte) médiée par l’ACE2 pourrait en soi favoriser la progression tumorale [83-86] . Il est remarquable que des pointes flottantes, des sous-unités S et des fragments de peptide S pénètrent dans la circulation et persistent dans le corps pendant des semaines [87,88] et même des mois [89] après la vaccination contre le COVID-19 à des concentrations comparables à celles trouvées. chez les patients atteints de COVID-19 sévère (Tableau 1 ) [89,90] .
| Antigène | Vaccination | Concentration (pg/mL) | Temps passé dans le corps (jours) |
| S * | BNT162b ARNm-1273 | Jours 1-2 après la première dose – taux médians de S : 47 pg/mL (plasma) | Présenter au moins 1 à 2 jours (plasma) et 60 jours (centres germinaux et ganglions lymphatiques) après la deuxième dose |
| Jour 7 après la première dose – taux médians de S : 1,7 pg/mL (plasma) | |||
| Jours 1-2 après la deuxième dose – niveaux médians de S : 1,2 pg/mL (plasma) | |||
| S, S1 ** | ARNm-1273 | Niveaux de pic moyens de S : 62 ± 13 pg/mL (plasma) | S présent jusqu’à 15 jours après la première dose, indétectable après la deuxième dose (plasma) |
| Niveaux maximaux moyens de S1 : 68 ± 21 pg/mL (plasma) | S1 présent jusqu’à 14 jours après la première dose, indétectable après la deuxième dose, niveaux maximaux à 5 jours (plasma) | ||
| Fragments S *** | BNT162b ARNm-1273 | – | 69 à 187 jours après la vaccination (plasma) |
Tableau 1 : Concentration et persistance dans l’organisme des antigènes Spike après vaccination médiée par l’ARNm
* : [87] , ** : [88] , *** : [89]
BNT162b : vaccin Pfizer/BioNTech, ARNm-1273 : vaccin Moderna
Il est donc impératif de surveiller les conséquences à moyen et long terme des vaccins contre la COVID-19 qui introduisent des pics dans le corps humain. Plus important encore, des modèles animaux expérimentaux appropriés doivent être développés pour comprendre la contribution et les implications fonctionnelles de ces cascades de signalisation en relation avec la progression du cancer, la récidive et/ou la sensibilité aux thérapies anticancéreuses.
Les vaccins à ARNm sont conçus pour désactiver l’immunité innée de l’hôte via les récepteurs de type Toll (TLR), compromettant ainsi les réponses à l’IFN de type I.
L’ADN et l’ARN stimulent le système immunitaire inné des mammifères grâce à l’activation des TLR, une classe de protéines principalement exprimées dans les cellules sentinelles (c’est-à-dire les cellules dendritiques et les macrophages) qui constituent la première ligne de défense contre les agents pathogènes envahisseurs et les molécules endogènes libérées par les cellules mourantes ou endommagées. cellules [91] . Les TLR déclenchent plusieurs voies de signalisation impliquant NF-κB, des facteurs de régulation de l’IFN (IRF) et des MAPK pour la production de diverses cytokines qui jouent un rôle important dans de nombreuses maladies, notamment le cancer. L’ARN signale en particulier via les TLR3, TLR7 et TLR8 endosomaux humains ; cependant, l’incorporation de nucléosides modifiés dans la molécule d’ARN supprime l’activité du TLR [92,93] . Les vaccins à ARNm contre le COVID-19 ont toutes les uridines de la séquence d’ARNm de pointe du SRAS-CoV-2 remplacées synthétiquement par la N1-méthyl-pseudouridine (m1Ψ) [94,95] . Un tel remplacement augmente la stabilité biologique, favorise la traduction de l’ARNm et inhibe considérablement la détection immunitaire innée, car une activation immunitaire incontrôlée pourrait conduire à des réactions allergiques indésirables et à un choc anaphylactique [94,96] .
Malgré la contribution essentielle des pseudouridines aux vaccins à ARNm contre la COVID-19, on sait peu de choses sur les conséquences biologiques de la délivrance d’ARNm hautement stabilisé modifié par m1Ψ dans le cytoplasme des cellules humaines. Par exemple, des études montrent que la vaccination avec BNT162b2 (le premier candidat de Pfizer/BioNTech à recevoir l’autorisation d’utilisation d’urgence de la FDA) a significativement diminué la production d’IFN-α (IFN de type I) et d’IFN-γ (IFN de type II) après stimulation avec l’agoniste TLR7/8. R848 et l’agoniste TL3 poly I:C [97] . Selon Föhse et al. [97] , la diminution de la sensibilité des TLR endosomaux qui interagissent avec l’ARNm modifié transfecté pourrait par la suite supprimer l’activité des TLR3/7/8 et diminuer la production de cytokines. Il est important de noter qu’une réponse immunitaire efficace implique l’induction d’une cascade de signalisation robuste de l’IFN de type I médiée par le TLR dans le cadre du système immunitaire inné. Si cette réponse est supprimée, une immunopathologie au cours d’infections virales lytiques et latentes peut en résulter [98,99] . Des défauts dans l’expression du TLR ont été rapportés chez des personnes atteintes d’infections à herpèsvirus [100,101] . Des mutations dans TLR3 et ses molécules de signalisation en aval ont été associées à des cas d’encéphalite à virus herpès simplex [102,103] , de méningo-encéphalite à virus varicelle-zona [102] et d’ophtalmique récurrente à herpès zoster [103] . Il convient de noter qu’un nombre de plus en plus élevé de cas de zona a été signalé après une vaccination contre la COVID-19 à ARNm (BNT162b2 et ARNm-1273), mais pas à la suite d’une vaccination contre la COVID-19 vectorisée par un adénovirus ou inactivée [104-109] . Une telle observation est cohérente avec une réponse altérée de l’IFN de type I médiée par le TLR, déclenchée par l’ARNm modifié par m1Ψ.
Le profilage multimodal unicellulaire du sang périphérique de patients atteints de COVID-19 aigu et de volontaires sains avant et après avoir reçu l’injection de BNT162b2 a également révélé des différences spectaculaires dans la réponse aux deux défis immunitaires. Chez les patients atteints de COVID-19, les réponses immunitaires étaient caractérisées par une réponse IFN de type I fortement augmentée, qui était largement absente chez les vaccinés. L’augmentation de la signalisation IFN a probablement contribué à la régulation positive drastique des gènes cytotoxiques dans les cellules T périphériques et les lymphocytes de type inné observés chez les patients atteints de COVID-19. L’analyse des répertoires de lymphocytes B et T a révélé que si la majorité des lymphocytes clonaux chez les patients atteints de COVID-19 étaient des cellules effectrices, chez les vaccinés, l’expansion clonale était principalement limitée aux cellules mémoire circulantes [110] . Malgré cela, il n’existe pas de large consensus quant à savoir si l’activité de l’IFN de type I est robuste [23,110,111] ou compromise [112,113] lors d’une infection par le SRAS-CoV-2. Par exemple, des preuves contraires montrent que la sous-unité S1 du SRAS-CoV-2 a directement supprimé l’expression des IFN ACE2 et de type I dans les cellules primaires du lavage broncho-alvéolaire pulmonaire des macaques [113] , contribuant ainsi à la maladie pulmonaire associée au SRAS-CoV-2. De plus, le diagnostic de COVID-19 chez les personnes de ≥ 50 ans a été associé à un risque accru de développer un zona [114,115] . Cette apparente controverse pourrait s’expliquer en partie par l’ajustement fin entre les réponses immunitaires antivirales aiguës qui permettent d’éliminer rapidement l’infection grâce à une sécrétion élevée d’IFN et celles qui conduisent à des schémas inflammatoires plus longs et plus robustes (c’est-à-dire des formes graves de COVID-19) avec épuisement fonctionnel. des réponses IFN [116] . Néanmoins, la lymphopénie périphérique (décrite à la fois chez les patients atteints d’une forme grave de la COVID-19 et chez les personnes vaccinées contre la COVID-19) pourrait alternativement (ou en plus) justifier la réactivation des infections latentes du zona chez les patients atteints de la COVID-19 et chez les personnes ayant reçu les vaccins à ARNm contre la COVID-19.
Remarquablement, les TLR sont exprimés non seulement dans les cellules immunitaires mais également dans les cellules tumorales, où ils peuvent à la fois inhiber et favoriser la malignité [117] . De nombreuses études chez l’homme et la souris soulignent l’importance de l’IFN endogène de type I, produit à la fois par les cellules immunitaires et tumorales, dans le contrôle de la croissance tumorale et dans la réponse aux thérapies antitumorales [118-120] . Seneff et al. [23] discutent en détail de la complexité et du rôle des IFN de type I, en particulier de l’IFN-α, dans la surveillance et la suppression du cancer. Les auteurs soulignent la gamme éblouissante d’effets anticancéreux initiés par l’IFN-α, à la fois directs (c’est-à-dire, arrêt du cycle cellulaire, apoptose et activation des cellules tueuses naturelles et des lymphocytes T CD8+) et indirects (c’est-à-dire, activation de la transcription génique de la Janus kinase/ mécanismes de transducteur de signal et activateur de transcription (voie JAK/STAT) [23] . La voie JAK/STAT est dérégulée dans plusieurs hémopathies malignes, ce qui augmente le potentiel métastatique dans les modèles animaux de mélanome, de cancer colorectal et de lymphome [121] . Des défauts dans la signalisation lymphocytaire de l’IFN surviennent chez les patientes atteintes d’un cancer du sein, d’un mélanome et d’un cancer gastro-intestinal, et ces défauts peuvent représenter un mécanisme courant de dysfonctionnement immunitaire associé au cancer [120] . De manière cohérente, l’administration exogène d’IFN de type I et/ou l’utilisation d’inducteurs d’IFN de type I renforcent les réponses immunitaires innées et adaptatives contre les tumeurs solides [122,123] .
Une altération des réponses à l’IFN de type I est également observée dans d’autres maladies, notamment les infections chroniques (c’est-à-dire le VIH/SIDA) et les maladies auto-immunes (c’est-à-dire la sclérose en plaques (SEP)). En interférant avec les réponses IFN de type I, le VIH-1 peut contourner la signalisation antivirale de l’hôte et établir des réservoirs viraux persistants. Les défauts médiés par le VIH-1 dans la voie de l’IFN comprennent l’altération des récepteurs protéiques impliqués dans la détection des agents pathogènes, les cascades de signalisation en aval nécessaires à la régulation positive de l’IFN de type I et l’expression ou la fonction de protéines antivirales clés inductibles par l’IFN de type I [124,125] . Il est remarquable que les personnes infectées par le VIH présentent un risque considérablement plus élevé de développer certains types de cancer par rapport à la population générale, notamment le sarcome de Kaposi, le lymphome non hodgkinien, le cancer du col de l’utérus [50] et, dans une moindre mesure, les cancers de l’anus, du foie. , de la cavité buccale/pharynx et du poumon et lymphome hodgkinien [51] . De même, les patients atteints de SEP dont la signalisation IFN de type I est supprimée et qui répondent bien au traitement par IFN [126,127] courent également un plus grand risque de développer un cancer que la population générale [128] . Ce risque accru est particulièrement apparent pour les cancers de la prostate, du sein, colorectal et anal, ainsi que pour les cancers de la trachée, des bronches et du poumon.
Dans l’ensemble, les rôles extrêmement compliqués et pléiotropes des réponses TLR et IFN de type I dans la biologie des tumeurs incitent à la prudence lors de l’introduction d’ARNm synthétiques (m1Ψs) pour des applications thérapeutiques in vivo. Plus important encore, les réponses perturbées de l’IFN de type I médiées par le TLR après une infection par le SRAS-CoV-2 et une vaccination par ARNm peuvent ne pas être comparables pour les raisons suivantes. Premièrement, l’ARNm synthétique modifié par m1Ψ, contrairement à l’ARN viral, a la capacité d’éliminer l’activité du TLR. Deuxièmement, des études récentes suggèrent que la production endogène de pointes synthétiques persiste pendant une longue période (> 6 mois) dans le corps humain [87-89] . Troisièmement, alors que la majeure partie de la protéine de pointe virale reste probablement dans les voies respiratoires, la production de pointe induite par le vaccin a lieu dans les organes et tissus internes, étant ainsi en mesure d’exercer des effets plus systémiques [129] . En effet, des études de biodistribution du vaccin BNT162b2 sur des modèles animaux ont révélé que le vaccin ne reste pas au site d’injection mais s’accumule plutôt dans différents organes (foie, rate, poumons, ovaires, etc.) 48 heures après l’inoculation [ 130 -133] . Dans ce contexte, Bansal et al. (134) ont démontré le rôle important des exosomes circulants exprimant la glycoprotéine de pointe à la surface pour une immunisation efficace après une vaccination à base d’ARNm. Ces exosomes étaient détectables 14 jours après la première injection, augmentaient après la dose de rappel et diminuaient considérablement après quatre mois. Il est donc plausible que les exosomes contribuent à la dispersion du pic (et de sa séquence d’ARNm) dans tout le corps, via le système lymphatique, le système vasculaire et même le long des fibres nerveuses. Enfin, le respect des calendriers de vaccination à doses multiples à des intervalles relativement courts [8] peut vraisemblablement augmenter le risque d’effets indésirables chez les vaccinés. D’autres études devraient faire la lumière sur les voies pro- et anti-tumorigènes pertinentes dépendantes du TLR qui peuvent être dérégulées à la suite d’une vaccination par ARNm et/ou d’une infection par le SRAS-CoV-2.
L’optimisation des codons des vaccins contre la COVID-19 pourrait entraîner une dérégulation du système de liaison aux protéines ARN-G quadruplex (G4), altérant ainsi la régulation translationnelle des microARN cellulaires
La conception des vaccins contre la COVID-19 implique différents types d’optimisations, notamment l’optimisation des codons [135] . L’optimisation des codons est une approche d’ingénierie génétique qui utilise des modifications synonymes de codons pour augmenter la production de protéines chez des hôtes qui n’expriment pas naturellement le gène. Ce processus augmente généralement le contenu en GC, ce qui est en corrélation avec un niveau accru de transcription, probablement en raison d’une diminution des pauses transcriptionnelles [136] . Certains auteurs estiment que l’optimisation des codons compromet la sécurité et l’efficacité des thérapies biotechnologiques [137] . McKernan et coll. [138] , Seneff et coll. [23] et d’autres décrivent que l’enrichissement significatif du contenu en GC dans les vaccins à ARNm COVID-19 (par rapport à l’ARNm natif du pic SARS-CoV-2) pourrait conduire à une augmentation des structures secondaires telles que les motifs G4 pendant la traduction. Plus précisément, McKernan et al. [138] présentent une série d’approches in silico telles que RNAfold et QGRSMapper qui montrent des changements dans la structure secondaire des ARN dérivés du vaccin par rapport au virus natif. Il convient de noter l’augmentation du nombre de formations G4 dans les vaccins à ARNm optimisés en codons (c’est-à-dire 19 et neuf motifs G4 dans les ARNm de Moderna et Pfizer/BioNTech, respectivement, contre quatre motifs G4 dans la région codante de pointe du SRAS-CoV- 2 virus). L’abondance des structures G4 dans l’ARNm vaccinal amplifie probablement l’attachement des protéines de liaison à l’ARN et des microARN qui ciblent normalement les G4 exprimés par l’homme pour une régulation normale de l’expression des gènes humains. De plus, l’utilisation de m1Ψ dans les ARNm vaccinaux obscurcit davantage les prédictions de repliement, car l’appariement de bases promiscuité de m1Ψ facilite les erreurs de traduction [135, 139-141] et stabilise les G4 [142, 143] , exacerbant ainsi l’impact de la formation de G4 avec l’optimisation des codons [138] .
Une dérégulation du système de liaison de l’ARN à la protéine G4 pourrait diminuer considérablement l’expression des microARN cellulaires, qui est impliquée dans de nombreuses pathologies telles que les maladies cardiovasculaires, l’apparition de la neurodégénérescence et la progression du cancer [23] . Un exemple, vital pour le fonctionnement normal des cellules, est celui de l’homologue de la souris double minute 2 (MDM2), qui est une protéine régulatrice physique négative de p53 (p53 est une protéine suppresseur de tumeur bien connue décrite ci-dessous). La dérégulation des microARN qui contrôlent l’interaction complexe entre MDM2 et p53 entraîne, de manière prévisible, un risque accru de divers cancers [23, 138, 144-146] . Un autre exemple est l’amplification des répétitions d’ARN G4 dans la sclérose latérale amyotrophique/démence frontotemporale (SLA/FTD) ( gène C90RF72 ) et le syndrome du X fragile ( gène FMR1 ) [147] . Dans ces maladies, des changements dans les niveaux d’expression ou des mutations des protéines liant l’ARN G4 sont également rapportés, ce qui suggère que ces protéines ne peuvent pas exercer leur fonction critique pour la physiologie neuronale normale lorsqu’elles sont mutées ou dans des cellules présentant des expansions d’ARN G4 [147] .
Dans une large mesure, ces observations mettent en évidence la complexité évoluée de l’utilisation des codons et remettent en question les bases scientifiques de l’optimisation des codons en thérapeutique humaine.
Les LNP utilisés dans les vaccins à ARNm sont hautement inflammatoires chez la souris
Les LNP sont un composant essentiel des vaccins contre la COVID-19 à base d’ARNm, jouant un rôle clé dans l’amélioration de la stabilité in vivo de l’ARNm et dans l’amélioration de l’administration au cytosol des cellules présentatrices d’antigènes [148] . Les LNP sont constitués de quatre composants principaux : un phospholipide neutre, du cholestérol, un lipide polyéthylène-glycol et un lipide cationique ionisable [149] .
Les propriétés hautement inflammatoires des LNP cationiques sont connues depuis 2010 [150] . Un rapport récent [150] a spécifiquement montré que les LNP utilisées dans les études précliniques sur le vaccin à ARNm modifié par des nucléosides contre la COVID-19 sont hautement inflammatoires chez la souris. L’injection intradermique de ces LNP a conduit à une infiltration massive de neutrophiles, à une activation rapide et robuste de diverses voies inflammatoires et à la production de diverses cytokines et chimiokines inflammatoires. L’administration intranasale a entraîné des réponses inflammatoires similaires dans les poumons [151] . Bien que l’activité adjuvante intrinsèque des LNP puisse contribuer à susciter une immunité protectrice, l’activation incontrôlée de diverses voies inflammatoires distinctes et convergentes et la sécrétion de cytokines et de chimiokines inflammatoires pourraient conduire à une inflammation et une cytotoxicité graves. Des études approfondies sont donc nécessaires pour cartographier les interactions entre les LNP cationiques et les récepteurs de reconnaissance de formes intracellulaires afin de découvrir les mécanismes intégrés et multiformes par lesquels ces lipides induisent l’activation de l’inflammasome [152] . De plus, s’il est probable que l’injection intramusculaire des complexes LNP-ARNm du vaccin COVID-19 déclenche des réponses similaires chez l’homme [151] , la nature exacte de ces réponses et leur chevauchement avec les signatures inflammatoires documentées chez la souris restent inconnues. De manière pertinente, les injections vectorisées d’adénovirus, contrairement aux vaccins à ARNm, n’induisent pas de réponses immunitaires innées graves (c’est-à-dire une tempête de cytokines), d’hyperinflammation ou de dommages majeurs dans les cellules ciblées [153] . À l’inverse, un COVID-19 sévère (qui touche environ 5 % de la population infectée par le SRAS-CoV-2) [154] déclenche une tempête de cytokines dans les tissus pulmonaires qui peut s’accompagner d’immunopathologie, de virémie et d’effondrement systémique de plusieurs organes [155-157]. ] .
Dans le contexte du cancer, l’inflammation prédispose au développement de la maladie et favorise toutes les étapes de la tumorigenèse [158] . L’inflammation extrinsèque de la tumeur est causée par de nombreux facteurs, notamment les infections bactériennes et virales, les maladies auto-immunes, l’obésité, le tabagisme, l’exposition à l’amiante et la consommation excessive d’alcool [158] . Environ 15 à 20 % de tous les cas de cancer sont précédés d’une infection, d’une inflammation chronique ou d’une auto-immunité au niveau du même tissu ou organe [158-164] . Dans de tels cas, une inflammation favorisant le cancer est induite et existe bien avant la formation de la tumeur. En revanche, l’inflammation intrinsèque au cancer ou provoquée par le cancer peut être déclenchée par des mutations initiatrices du cancer, contribuant ainsi à la progression maligne par le recrutement et l’activation de cellules inflammatoires [158] . L’inflammation tant extrinsèque qu’intrinsèque peut entraîner une immunosuppression, fournissant ainsi un contexte privilégié pour le développement d’une tumeur. Il convient de noter que les neutrophiles sont activement impliqués dans un réseau de réactions inflammatoires qui favorisent toutes les étapes de l’initiation, de la progression, de l’angiogenèse et des métastases de la tumeur [165-170] . Les neutrophiles forment des pièges extracellulaires à neutrophiles (TNE) qui, lorsqu’ils sont dérégulés, conduisent à l’exacerbation de l’inflammation [171,172] , à une progression incontrôlée du cancer, au réveil des DCC et à une dissémination métastatique, à la fois chez les modèles animaux et chez les patients atteints de cancer [173] . De plus, le microenvironnement tumoral, largement orchestré par les cellules inflammatoires, favorise la prolifération, la survie et la migration des cellules néoplasiques. De manière marquée, les réponses inflammatoires sont aggravées sur fond de conditions inflammatoires préexistantes, comme cela a été récemment démontré dans un modèle murin après l’administration d’ARNm-LNP [174] . Cet effet s’est avéré spécifique aux LNP, agissant indépendamment de la cargaison d’ARNm. Étant donné que les LNP s’accumulent souvent dans les tumeurs, en raison d’un effet de perméabilité et de rétention (EPR) accru [175-178] , la protection des cellules cancéreuses contre les stimuli de stress liés à la transformation, notamment l’inflammation et l’action pro-tumorigène des TNE, est d’une importance capitale. Comprendre les interactions entre les LNP et les neutrophiles [179] devrait donc être essentiel pour le développement de nanomatériaux sûrs et efficaces.
La transcription inverse potentielle et l’intégration génomique d’ARN étranger sont une source d’instabilité génomique
Une nouvelle étude d’Acevedo-Whitehouse et Bruno [180] discute de la possibilité que des parties du génome du SRAS-CoV-2 puissent subir une transcription inverse et une intégration génomique au sein des cellules infectées, conduisant à une transcription persistante des séquences intégrées. Cette hypothèse est basée sur une étude in vitro qui a détecté la présence de copies de transcription inverse des séquences du SRAS-CoV-2 dans des cellules humaines transfectées et a trouvé une transcription active des segments sous-génomiques intégrés [181] . Acevedo-Whitehouse et Bruno pensent que le même phénomène pourrait se produire dans les cellules humaines ayant reçu des vaccins à ARNm contre le COVID-19. En effet, une étude récente d’Aldén et al. [182] ont rapporté qu’un rétrotransposon endogène, à savoir l’élément nucléaire 1 longuement intercalé (LINE-1), n’était pas inhibé après l’entrée de l’ARNm de BNT162b2 dans la cellule. Cela a conduit à la transcription inverse des séquences complètes d’ARNm du vaccin et à l’entrée nucléaire ultérieure.
Si ces résultats sont confirmés in vivo, l’activité soutenue de LINE-1 non inhibée, qui est normalement réprimée dans les cellules somatiques, pourrait augmenter le risque de mutagenèse insertionnelle des molécules à transcription inverse, ce qui, à son tour, pourrait perturber les régions codantes, améliorer le risque de mutations dans les gènes suppresseurs de tumeurs et entraîne des dommages durables à l’ADN dans les cellules et les tissus ciblés par le vaccin [180] . La rétrotransposition LINE-1 est en effet une caractéristique majeure du cancer [183] et est en corrélation avec les mutations de p53, les altérations du nombre de copies et les points de contrôle de la phase S du cycle cellulaire [184] . Il est important de noter que l’activation de LINE-1 augmente le risque de transition épithéliale-mésenchymateuse et de métastases dans le cancer épithélial, qui représente 80 à 90 % de tous les cancers humains connus [185] . Il existe donc un besoin urgent de clarté sur l’activation potentielle de LINE-1 induite par le COVID-19 et le vaccin COVID-19 et ses répercussions sur les cellules cancéreuses et/ou précancéreuses présentant des niveaux intrinsèquement élevés d’expression de LINE-1.
De plus, si les séquences du vaccin à ARNm de pointe du SRAS-CoV-2 sont transcrites de manière inverse, intégrées dans le génome des cellules ciblées et exprimées sous forme de transcrits chimériques combinant des séquences virales et cellulaires, une dérégulation du système de liaison à la protéine ARN G4 pourrait favoriser davantage la malignité. . En effet, des études expérimentales et des prédictions bioinformatiques soutiennent l’idée selon laquelle les G4 sont impliqués dans différentes fonctions cellulaires associées à la fois aux processus de l’ADN (c’est-à-dire l’élongation des télomères, la recombinaison et la transcription) et aux mécanismes post-transcriptionnels de l’ARN (c’est-à-dire le traitement pré-ARNm, le renouvellement de l’ARNm, le ciblage). , et traduction) [186] . Comme indiqué précédemment, un nombre croissant de maladies différentes (c’est-à-dire transformation néoplasique et neurodégénérescence) ont été associées à une régulation inappropriée des ARN G4, illustrant l’importance potentielle de ces structures pour la santé humaine. Notamment, la formation de la structure G4, si elle n’est pas régulée efficacement, peut stimuler l’instabilité du génome, induisant des mutations, des délétions et des réarrangements chromosomiques macroscopiques complexes [187] . Une étude informatique comparant l’emplacement des sites potentiels de formation de G4 avec les points d’arrêt associés au cancer a révélé un chevauchement significatif, en particulier dans les cancers qui hébergent des mutations dans TP53 (le gène qui code pour p53). Ceci est souligné par des études informatiques sur des cellules de mélanome qui ont lié les régions G4 à des points chauds de mutation [188] . De plus, Hänsel-Hertsch et al. [189] ont identifié une corrélation directe entre les G4 et les changements mutationnels dans différentes entités du cancer du sein. Cela conforte l’idée selon laquelle la formation de G4 stimule et influence les taux de mutation dans différents cancers.
La sous-unité S2 de la glycoprotéine de pointe du SRAS-CoV-2 interagit avec les protéines suppresseurs de tumeurs p53 et le cancer du sein 1/2 (BRCA1/2) in silico
À l’aide d’analyses bioinformatiques (in silico), Singh et Bharara [190] ont prouvé que la sous-unité S2 du SARS-CoV-2 interagit fortement avec les protéines suppresseurs de tumeurs bien connues p53 et BRCA1/2, qui sont fréquemment mutées dans les cancers humains. Ces protéines constituent une barrière majeure à la transformation néoplasique et à la progression tumorale grâce à leur capacité unique à agir comme des collecteurs extrêmement sensibles des entrées de stress et à coordonner un cadre complexe de diverses voies et processus effecteurs qui protègent l’homéostasie cellulaire et l’intégrité du génome. p53 et BRCA1/2 agissent principalement dans le noyau cellulaire en régulant la progression du cycle cellulaire, la réparation et la recombinaison des dommages à l’ADN et la transcription des gènes [191-193] . Cependant, ces protéines jouent également un rôle essentiel dans le cytoplasme, déclenchant l’apoptose et inhibant l’autophagie, contribuant ainsi à leur mission de suppresseurs de tumeurs [194,195] . Il a été rapporté que p53 de type sauvage était anormalement séquestré dans le cytoplasme d’un sous-ensemble de tumeurs humaines primaires [196] . Une myriade de mutations associées au cancer qui perturbent le ciblage nucléaire de BRCA1 limitent la protéine au cytosol et diminuent sa fonction nucléaire dans la réparation par recombinaison homologue des cassures de l’ADN [197] . Notamment, l’accumulation cytosolique de BRCA1 favorise les métastases du cancer du sein [198] et prédit indépendamment la survie, le grade de la tumeur et la récidive dans les cancers du sein sporadiques de type basal de bas grade [199] .
Si, comme in silico, la sous-unité S2 de Spike interagit avec des protéines suppresseurs de tumeurs in vivo, une telle démonstration aurait des implications non seulement sur la santé à long terme des personnes touchées par le COVID-19, mais également sur celles qui ont reçu la vaccination contre le COVID-19. et des doses de rappel répétées. En effet, les vaccins à ARNm et à adénovirus vectorisés contiennent le matériel génétique qui ordonne aux cellules hôtes d’exprimer Spike. Comme décrit ci-dessus, les études de biodistribution du vaccin BNT162b2 ont révélé son accumulation dans différents organes 48 heures après l’inoculation [130-134] . Plus important encore, les LNP, qui sont un composant essentiel des vaccins à ARNm, s’accumulent préférentiellement dans les tissus tumoraux plutôt que dans les tissus sains en raison de l’effet EPR [175-178] . Sur la base de ces résultats, il est essentiel de déchiffrer la portée, le rôle détaillé et les conséquences biologiques des interactions potentielles entre S2 et les protéines suppresseurs de tumeurs (c.-à-d. p53 et BRCA1/2) chez les patients atteints de COVID-19 et les vaccinés, en particulier si ces interactions confèrent un avantage sélectif (c’est-à-dire promotion de la survie des cellules cancéreuses, de l’invasion, des métastases et de la chimiorésistance) aux cellules cancéreuses et/ou précancéreuses.
Les cancers associés aux mutations TP53 comprennent le cancer du sein, les sarcomes des os et des tissus mous, les tumeurs cérébrales et les carcinomes corticosurrénaliens. D’autres cancers moins fréquents comprennent la leucémie, le cancer de l’estomac et le cancer colorectal [200] . Les cancers associés à une activité altérée de BRCA1 comprennent le cancer du sein, de l’utérus et des ovaires chez les femmes, le cancer de la prostate et du sein chez les hommes, ainsi qu’une légère augmentation du cancer du pancréas chez les hommes et les femmes [201,202] . Les cancers les plus fréquemment rapportés avec des mutations BRCA2 comprennent le pancréas, la prostate chez les hommes et le mélanome [203] .
Une dérégulation et/ou des modifications aberrantes des niveaux/activité de p53 [204,205] ainsi que la séquestration cytoplasmique de BRCA1 [206] ont également été liées à un dysfonctionnement neuronal. Par conséquent, l’interaction potentielle in vivo entre S2 et les protéines suppresseurs de tumeurs pourrait avoir des conséquences non seulement sur les cellules cancéreuses à cycle rapide, mais également sur les cellules non cycliques (notamment les neurones) et donc sur les maladies neurodégénératives à longue latence [207, 208] .
La protéine transmembranaire du groupe de différenciation 147 (CD147), une nouvelle voie d’entrée de l’infection par le SRAS-CoV-2 dans les cellules hôtes, est corrélée à divers cancers
Récemment, une nouvelle voie d’entrée du SRAS-CoV-2 a été proposée, à savoir l’utilisation de la glycoprotéine transmembranaire CD147 [209] . Malgré une moindre affinité pour la protéine de pointe du SRAS-CoV-2, par rapport à l’ACE2, le CD147 pourrait être un récepteur complémentaire dans la médiation de l’infection virale [210] . Bien qu’il manque actuellement des preuves sans équivoque soutenant une interaction directe entre Spike et CD147 [211] , la confirmation du CD147 en tant que nouvelle cible virale du SRAS-CoV-2 pourrait avoir de sérieuses implications pour les patients en oncologie. Le CD147 a été corrélé à divers cancers [212,213] et il a été démontré qu’il participe à la régulation positive du microenvironnement tumoral et à la progression du cancer par plusieurs mécanismes, à savoir le contrôle de la glycolyse et sa capacité bien connue à induire des protéinases conduisant à une dégradation de la matrice, invasion de cellules tumorales, métastases et angiogenèse [214] . Comme décrit précédemment pour ACE2, l’interaction possible de la glycoprotéine de pointe du SRAS-CoV-2 avec les récepteurs CD147 pourrait, grâce à l’activation des voies tumorigènes, ouvrir la voie à la progression et/ou à la récidive du cancer.
Envisagement de la vaccination contre la COVID-19 chez les personnes atteintes d’un cancer ou ayant des antécédents de cancer
La vaccination contre le COVID-19 est la plus grande campagne de vaccination d’urgence jamais tentée dans l’histoire de l’humanité [215] . Bien que la pandémie ait largement disparu du discours public, environ 2 000 à 3 000 Américains meurent encore du COVID-19 chaque semaine [216] , et la même tendance est observée au Royaume-Uni [217] , peut-être parce que certains collectifs (c’est-à-dire les personnes âgées) , les personnes présentant des comorbidités et les personnes immunodéprimées) sont toujours confrontées à un risque élevé de maladie grave, en particulier maintenant que presque tous les pans de la société sont revenus à la normale. Par conséquent, la protection de millions de personnes reste un défi et une responsabilité considérables. Bien que les vaccins puissent avoir eu un impact significatif sur la prévention des décès, les conséquences graves des vaccins sur la santé peuvent passer inaperçues dans les essais cliniques et/ou les systèmes de surveillance passive tels que le VAERS, en particulier s’ils ont une latence moyenne ou longue et ne nécessitent pas une hospitalisation immédiate. Dans ce contexte, nous avons montré que les vaccins à base de glycoprotéines de pointe du SRAS-CoV-2 ont le potentiel d’interagir avec les protéines suppresseurs de tumeurs, de favoriser l’inflammation, d’activer les voies oncogènes et de perturber le réglage fin de la réponse immunitaire. Ces mécanismes dérégulés et ces voies de signalisation sont à l’origine de la plupart des types de cancer. De plus, le potentiel génotoxique du Spike a été récemment étudié chez des adultes de guppy ( Poecilia reticulata , également connu sous le nom de millionfish ou poisson arc-en-ciel) exposés à des fragments de Spike du SRAS-CoV-2 dispersés dans l’eau douce [218] . L’exposition à ces peptides a induit une instabilité génomique et des dommages à l’ADN dans les érythrocytes circulants de P. reticulata , qui étaient en corrélation avec un déséquilibre rédox marqué par une augmentation des taux de malondialdéhyde (MDA) dans le foie et le cerveau, ainsi qu’en supprimant l’activité antioxydante du foie. superoxyde dismutase (SOD) et catalase (CAT).
Même si nous comprenons qu’une grande partie des discussions sur le cancer et la vaccination contre la COVID-19 se sont déroulées sous haute pression afin de protéger cette cohorte contre les maladies graves et la mort, une évaluation risque/bénéfice plus équilibrée est nécessaire de toute urgence. Ceci est particulièrement pertinent pour les personnes ayant une faible réponse immunitaire, comme celles atteintes d’hémopathies malignes [219,220] , pour lesquelles les bénéfices de la vaccination sont douteux et les risques cumulés des rappels successifs sont inconnus (bien qu’ils puissent augmenter avec chaque dose reçue). L’observation selon laquelle certains médicaments anticancéreux rendent les vaccins contre la COVID-19 inefficaces est particulièrement préoccupante [221,222] . De plus, la co-administration de régimes anticancéreux complexes et de vaccins contre la COVID-19 [222-224] pourrait ouvrir la voie à des effets toxiques intercurrents ou synergiques. En effet, un article récent [224] sur les effets du vaccin BNT162b2 chez les patients oncologiques sous inhibiteurs de points de contrôle (CPI) décrit que l’immunothérapie par CPI a entraîné une augmentation constante et variable de tous les effets secondaires de la vaccination contre le COVID-19, ce qui est alarmant. On craint donc que l’utilisation simultanée de l’immunothérapie et des vaccins contre la COVID-19 renforce la réponse immunitaire de l’organisme, entraînant ainsi une augmentation des événements indésirables liés au système immunitaire. De plus, les adénopathies axillaires réactives secondaires aux vaccins contre la COVID-19 peuvent imiter des métastases cancéreuses, posant un dilemme diagnostique et augmentant l’anxiété chez les patientes atteintes d’un cancer du sein, de cancers de la tête et du cou, d’un lymphome et d’un mélanome du dos et des membres supérieurs, qui sont toutes des tumeurs malignes qui ont une prédilection pour les métastases vers ces stations ganglionnaires [225-229] . Plus précisément, une clinique du sein en Israël a récemment signalé une augmentation de 394 % des lymphadénopathies par rapport aux années précédentes, et une étude incluant 169 patientes israéliennes subissant une tomodensitométrie par émission de positons (TEP-CT) 7 à 10 semaines après avoir reçu le la deuxième dose du vaccin BNT162b a décrit une lymphadénopathie unilatérale persistante chez 29 % des patients [225] . En revanche, quelques rares cas de rémission temporaire ou prolongée du cancer après une vaccination contre la COVID-19 [230] et une vaccination contre la COVID-19 à base d’ARNm [231] ont été rapportés, probablement en raison de la réponse immuno-inflammatoire intense qui aurait pu provoquer immunité anticancéreuse chez ces individus. Dans l’ensemble, le cancer est l’une des maladies humaines les plus complexes, hétérogènes et dynamiques [232,233] et, en tant que telle, une approche universelle « universelle » est imparfaite.
Malheureusement, la plupart des statistiques actuelles sur le cancer dans le monde (c’est-à-dire au Japon, en Australie, au Canada et en Europe) ne s’étendent pas au-delà de 2020 [234-239] , à moins qu’il ne s’agisse d’estimations ou de projections. Il est donc impératif de créer des bases de données mondiales de pharmacovigilance qui aident à prendre des décisions fondées sur les meilleures preuves disponibles à chaque instant. Aux États-Unis, du 7 janvier 2018 au 2 juillet 2022, les rapports hebdomadaires du CDC sur la mortalité et la morbidité (MMWR) ont répertorié environ 13 000 décès par cancer par semaine (fourchette : 12 221 à 14 845), avec des pics survenus en janvier 2021 (14 284 décès). ) et janvier 2022 (14 845 décès) [240] . Bien que l’agence de santé publique ait précisé que le nombre de décès par cancer (le cancer étant la cause sous-jacente) a légèrement augmenté entre 2018 et 2022, elle a principalement attribué la surmortalité par cancer à des causes sous-jacentes non cancéreuses, telles que le COVID-19. Il ne fait aucun doute que les pics de mortalité par cancer observés en 2021 et 2022 correspondent bien aux poussées hivernales de la COVID-19. Cependant, ils font également suite à deux grandes campagnes de vaccination et de rappel contre le COVID-19. Comme indiqué précédemment, les vaccins à base de protéines de pointe contre le SRAS-CoV-2 et le SRAS-CoV-2 favorisent la production de pointes dans les cellules humaines, ce qui, à la lumière de ce qui précède, pourrait faciliter la transformation maligne. Les enregistrements chaotiques de décès au cours des vagues pandémiques pourraient également avoir créé une distorsion des faits, trompant les efforts visant à prévenir les principales causes de décès par cancer (et autres). Il convient de noter que des recherches ont montré que, même dans des circonstances normales, les erreurs critiques dans les certificats de décès sont assez courantes aux États-Unis, la fréquence des erreurs allant de 18 % à 85 % ou plus dans les études menées en milieu hospitalier [241] .
En bref, malgré le fait que de nombreuses institutions [242,243] et auteurs [244,245] soutiennent que les vaccins contre la COVID-19 sont sûrs et (partiellement) efficaces chez les patients atteints de cancer, ces affirmations ne sont pas étayées et les recommandations sont largement déduites de la sécurité et de l’efficacité des vaccins. dans la population générale, les performances des autres vaccins chez les patients atteints de cancer et les altérations immunitaires inhérentes aux traitements anticancéreux actuels [246] . Compte tenu des preuves convergentes d’association temporelle et de plausibilité biologique, la contribution des vaccins génétiques contre le COVID-19 à la progression et à la récidive du cancer ne peut être exclue à l’heure actuelle. Pourtant, on pourrait affirmer que le potentiel oncogène du pic devrait également s’exercer lors de l’infection par le SRAS-CoV-2. Bien que cela soit en partie vrai, nous avons déjà évoqué le fait que les vaccins génétiques contre le COVID-19 et, en particulier, les injections d’ARNm sont radicalement différents de l’infection virale par le SRAS-CoV-2. Par conséquent, le rôle de la vaccination contre la COVID-19 et de l’infection par le SRAS-CoV-2 dans les voies susceptibles de favoriser la malignité n’est peut-être pas comparable et mérite une enquête plus approfondie. En outre, si les dommages peuvent être attribués de manière concluante au véhicule LNP lui-même et/ou à l’ARNm synthétique modifié (indépendamment de la toxicité, ou de l’absence de toxicité, du Spike), cela pourrait avoir des implications pour le développement de nouveaux produits d’ARNm basés sur le même technologie de base [247] .
Au vu de l’état actuel de la technique, nous suggérons que les personnes atteintes d’un cancer ou ayant des antécédents de cancer ne devraient recevoir les vaccins génétiques contre la COVID-19 que si les bénéfices l’emportent clairement sur les risques et après une évaluation minutieuse au cas par cas. Plus important encore, il existe la possibilité que le risque de cancer dépende de la dose. Selon le « modèle de carcinogenèse à coups multiples » proposé par Sutherland et Bailer [248] , il faut plusieurs coups ou insultes différentes envers les cellules et leur machinerie génétique pour qu’une cellule normale devienne cancéreuse. Étant donné que les vaccins contre la COVID-19 ne constituent pas une série primaire de protection mais plutôt des injections périodiques (tous les six mois) sans aucun point d’arrêt, il est possible que seules les personnes ayant reçu plusieurs vaccinations (et/ou présentant un risque élevé de cancer ou de rechute de cancer) soient vaccinées. à un risque plus élevé de malignité. Des recherches cliniques et fondamentales multidisciplinaires comparant les bases cellulaires et moléculaires des effets oncogènes induits par le vaccin contre la COVID-19 et contre la COVID-19 pourraient aider à rééquilibrer le profil risque/bénéfice de ces produits. Les approches directes, telles que l’utilisation de modèles animaux, devraient tirer parti du développement récent de souris exprimant les récepteurs ACE2 humains [249,250] et de la disponibilité de modèles de souris cancéreuses [250] . Les études portant sur l’efficacité et la sécurité de la vaccination contre la COVID-19 chez les patients atteints de cancer, tant de manière prospective que rétrospective, sont fortement encouragées. Les facteurs associés au patient et au traitement méritent une attention particulière. La nécessité de bases de données plus fiables incluant des paramètres immunitaires largement mesurés ainsi que des données sur les niveaux de protéines de pointe dans le sang a été soulignée par d’autres [251] . Prises ensemble, ces études devraient fournir des données solides pour guider la mise en œuvre clinique, y compris le développement d’alternatives thérapeutiques (c’est-à-dire des LNP avec une chimie différente, une forme fermée de pointe non sujette à la liaison de l’ACE2 [252] , des vaccins ne ciblant pas les pointes [253] , des plateformes telles que COH04S1 [254] à haute tolérance et immunogénicité chez les personnes immunodéprimées, des interventions non pharmacologiques [255] , etc.), pour ceux qui ne bénéficient pas d’une vaccination active contre le COVID-19 (et ceux qui sont allergiques à certains des les composants du vaccin).
Conclusions
Cette revue complète de la littérature vise à mettre en évidence le potentiel des vaccins génétiques contre la COVID-19, en particulier les vaccins à ARNm, pour répondre à l’hypothèse de l’oncogenèse à succès multiples proposée initialement par Sutherland et Bailor en 1984, dans la mesure où ils suscitent un milieu pro-tumorigène favorable. à la progression du cancer et/ou à la récidive (métastatique). Prouver que cette potentialité est fausse est une étape nécessaire pour satisfaire au premier principe de la médecine : « primum non nocere » (« d’abord, ne pas nuire »). En effet, toutes les crises mondiales posent d’énormes défis en matière de santé et de bien-être ; Pourtant, de telles exceptions ne devraient pas justifier un abaissement des normes scientifiques. Cela est particulièrement pertinent pour les médicaments prophylactiques destinés à protéger les populations vulnérables à haut risque à travers le monde. Précisément, le succès des nouveaux vaccins à base d’ARNm contre le COVID-19 a suscité un intérêt généralisé pour la technologie de l’ARNm comme solution à certaines des maladies infectieuses les plus mortelles (c’est-à-dire le paludisme, la tuberculose et le VIH/SIDA) pour lesquelles un traitement efficace et efficace. un vaccin facilement déployable est nécessaire de toute urgence. Cependant, étant donné que certains des mécanismes pro-oncogènes décrits sont indépendants de l’antigène, les problèmes de sécurité actuels doivent être rapidement résolus avant que les nanomédicaments à base d’ARNm ne transforment davantage la manière dont les maladies sont gérées et prévenues à l’avenir.
Les références
- Meslé MM, Brown J, Mook P, et al. : Nombre estimé de décès directement évités chez les personnes de 60 ans et plus grâce à la vaccination contre la COVID-19 dans la Région européenne de l’OMS, de décembre 2020 à novembre 2021 . Surveillance de l’euro. 2021, 26 : 10.2807/1560-7917.ES.2021.26.47.2101021
- Gupta S, Cantor J, Simon KI, Bento AI, Wing C, Whaley CM : Les vaccinations contre le COVID-19 auraient pu éviter jusqu’à 140 000 décès aux États-Unis . Affaire Santé (Millwood). 2021, 40 : 1465-72. 10.1377/hlthaff.2021.00619
- Watson OJ, Barnsley G, Toor J, Hogan AB, Winskill P, Ghani AC : Impact mondial de la première année de vaccination contre le COVID-19 : une étude de modélisation mathématique . Lancet InfectDis. 2022, 22 : 1293-302. 10.1016/S1473-3099(22)00320-6
- Savinkina A, Bilinski A, Fitzpatrick M, et al. : Estimation des décès évités et du coût par vie sauvée en intensifiant la vaccination à ARNm contre le COVID-19 dans les pays à faible revenu et à revenu intermédiaire inférieur à l’ère de la variante COVID-19 Omicron : a étude de modélisation . BMJ ouvert. 2022, 12:e061752. 10.1136/bmjopen-2022-061752
- Steele MK, Couture A, Reed C, et al. : Nombre estimé d’infections au COVID-19, d’hospitalisations et de décès évités parmi les personnes vaccinées aux États-Unis, de décembre 2020 à septembre 2021 . JAMA Netw ouvert. 2022, 5:e2220385. 10.1001/jamanetworkopen.2022.20385
- Jones M, Khader K, Branch-Elliman W : Impact estimé de la campagne de vaccination américaine contre le COVID-19 : atteindre 94 % des décès évités . JAMA Netw ouvert. 2022, 5:e2220391. 10.1001/jamanetworkopen.2022.20391
- Le CDC recommande une mise à jour du vaccin COVID-19 pour la saison virale automne/hiver . (2023). Consulté : 20 novembre 2023 : https://www.cdc.gov/media/releases/2023/p0912-COVID-19-Vaccine.html .
- NCCN : Vaccination contre le cancer et la COVID-19 version 8.0 06/03/2023 : Recommandations du Comité consultatif sur la vaccination contre la COVID-19 du National Comprehensive Cancer Network® (NCCN®) * . (2023). Consulté : 2 novembre 2023 : https://www.eviq.org.au/getmedia/6de8cf1f-54d5-4c5d-9045-f3b5ff384bbc/2021-covid-19-vaccination-guidance-v8-0.pdf.aspx .
- Ferdinands JM, Rao S, Dixon BE, et al. : Diminution de l’efficacité des vaccins à 2 et 3 doses des vaccins à ARNm contre les consultations et les hospitalisations associées aux services d’urgence et aux soins d’urgence associés au COVID-19 chez les adultes pendant les périodes de prédominance des variantes Delta et Omicron – Vision Network, 10 États, août 2021-janvier 2022 . MMWR Morb Mortal Wkly Rep. 2022, 71 : 255-63. 10.15585/mmwr.mm7107e2
- Le système immunitaire et le cancer . (2020). Consulté : 13 septembre 2022 : https://www.cancerresearchuk.org/about-cancer/what-is-cancer/body-systems-and-cancer/the-immune-system-and-cancer .
- Une étude visant à évaluer l’efficacité, l’innocuité et l’immunogénicité du vaccin à ARNm-1273 chez les adultes âgés de 18 ans et plus pour prévenir le COVID-19 . (2023). Consulté : 2 juillet 2023 : https://clinicaltrials.gov/study/NCT04470427 .
- Étude visant à décrire l’innocuité, la tolérabilité, l’immunogénicité et l’efficacité des candidats vaccins à ARN contre le COVID-19 chez des individus en bonne santé . (2023). Consulté : 2 juillet 2023 : https://classic.clinicaltrials.gov/ct2/show/NCT04368728 .
- Étude de phase III en double aveugle, contrôlée par placebo, sur l’AZD1222 pour la prévention du COVID-19 chez l’adulte . (2023). Consulté : 2 juillet 2023 : https://classic.clinicaltrials.gov/ct2/show/NCT04516746 .
- Une étude de phase 3 randomisée, en double aveugle et contrôlée par placebo pour évaluer l’efficacité et l’innocuité de l’Ad26.COV2.S pour la prévention du COVID-19 médié par le SRAS-CoV-2 chez les adultes âgés de 18 ans et plus . (2020). Consulté : 2 juillet 2023 : https://www.jnj.com/coronavirus/ensemble-1-study-protocol .
- He Z, Erdengasileng A, Luo X, Xing A, Charness N, Bian J : Comment la communauté de la recherche clinique a répondu à la pandémie de COVID-19 : une analyse des études cliniques sur le COVID-19 dans ClinicalTrials.gov . JAMIA Ouvert. 2021, 4:ooab032. 10.1093/jamiaopen/ooab032
- Goldman S, Bron D, Tousseyn T, et al. : Progression rapide du lymphome angio-immunoblastique à cellules T après une injection de rappel du vaccin à ARNm BNT162b2 : un rapport de cas . Front Med (Lausanne). 2021, 8:798095. 10.3389/fmed.2021.798095
- Adin ME, Wu J, Isufi E, Tsui E, Pucar D : Lymphadénopathie axillaire maligne ipsilatérale et ganglions lymphatiques réactifs controlatéraux chez une receveuse du vaccin COVID-19 atteinte d’un cancer du sein . J Cancer du sein. 2022, 25:140-4. 10.4048/jbc.2022.25.e12
- Ang SY, Huang YF, Chang CT : Leucémie lymphoblastique aiguë à cellules B Ph-positive survenant après la réception d’un rappel du vaccin bivalent à ARNm du SRAS-CoV-2 : un rapport de cas . Médicine (Kaunas). 2023, 59:627. 10.3390/medicine59030627
- Plüß M, Mitteldorf C, Szuszies CJ, Tampe B : Rapport de cas : hémophilie acquise après une vaccination de rappel d’ARNm-1273 contre le SRAS-CoV-2 avec diagnostic concomitant de sarcome cutané pléomorphe . Immunol avant. 2022, 13:868133. 10.3389/fimmu.2022.868133
- Norimatsu Y, Yoshizaki A, Yamada T, Akiyama Y, Toyama S, Sato S : Pemphigus vulgaris avec cancer hypopharyngé et gastrique avancé après la vaccination contre le SRAS-CoV-2 . J Dermatol. 2023, 50 : e74-5. 10.1111/1346-8138.16539
- Veeraballi S, Patel A, Are G, Ramahi A, Chittamuri S, Shaaban H : Un cas de leucémie myélomonocytaire chronique démasqué après avoir reçu le vaccin J&J COVID-19 . Curéus. 2022, 14 : e26070. 10.7759/cureus.26070
- Système de notification des événements indésirables liés aux vaccins . (2022). Consulté : 2 décembre 2022 : https://vaers.hhs.gov/ .
- Seneff S, Nigh G, Kyriakopoulos AM, McCullough PA : Suppression immunitaire innée par les vaccinations à ARNm du SRAS-CoV-2 : le rôle des G-quadruplexes, des exosomes et des microARN . Toxicol chimique alimentaire. 2022, 164:113008. 10.1016/j.fct.2022.113008
- Damen MP, van Rheenen J, Scheele CL : Cibler les cellules tumorales dormantes pour prévenir la récidive du cancer . FEBS J. 2021, 288 : 6286-303. 10.1111/févr.15626
- Blasco MT, Espuny I, Gomis RR : Écologie et évolution des métastases dormantes . Tendances Cancer. 2022, 8 : 570-82. 10.1016/j.trecan.2022.03.002
- Traitement du cancer et survie. Faits et chiffres 2019-2021 . (2022). Consulté : 19 avril 2022 : https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/cancer-treatment-and-survivorship-… .
- Dai M, Liu D, Liu M et al. : Les patients atteints de cancer semblent plus vulnérables au SRAS-CoV-2 : une étude multicentrique pendant l’épidémie de COVID-19 . Découverte du cancer. 2020, 10:783-91. 10.1158/2159-8290.CD-20-0422
- Pologne GA, Ovsyannikova IG, Kennedy RB : Immunité au SRAS-CoV-2 : examen et applications aux candidats vaccins de phase 3 . Lancette. 2020, 396 : 1595-606. 10.1016/S0140-6736(20)32137-1
- Saini G, Aneja R : Le cancer comme séquelle potentielle d’un long COVID-19 . Essais biologiques. 2021, 43 : e2000331. 10.1002/bies.202000331
- Francescangeli F, De Angelis ML, Baiocchi M, Rossi R, Biffoni M, Zeuner A : Modifications induites par le COVID-19 dans le microenvironnement tumoral : affectent-elles le réveil du cancer et la rechute métastatique ? . Oncol avant. 2020, 10:592891. 10.3389/fonc.2020.592891
- Questions et réponses : Ned Sharpless sur le COVID-19 et la prévention du cancer . Cancer Prev Res (Phila). 2021, 14:615-8. 10.1158/1940-6207.CAPR-21-0146
- Comment se remettre de 5 mauvaises habitudes prises pendant la pandémie de COVID-19 . (2022). Consulté : 16 novembre 2022 : https://healthmatch.io/blog/how-to-reboot-from-5-bad-habits-picked-up-during-the-covid-19-pandemic .
- Une étude suggère un lien entre le stress et la récidive du cancer . (2021). Consulté : 21 avril 2022 : https://www.cancer.gov/news-events/cancer-currents-blog/2021/cancer-returning-stress-hormones .
- Tavakolpour S, Rakhshandehroo T, Wei EX, Rashidian M : Lymphopénie pendant l’infection au COVID-19 : ce qu’elle montre et ce qui peut être appris . Immunol Lett. 2020, 225 : 31-2. 10.1016/j.imlet.2020.06.013
- Adamo S, Chevrier C, Cervia C, et al. : La prolifération des lymphocytes T induite par la lymphopénie est une caractéristique du COVID-19 sévère [PREPRINT] . bioRxiv. 2020, 10.1101/2020.08.04.236521
- Härter G, Spinner CD, Roider J, et al. : COVID-19 chez les personnes vivant avec le virus de l’immunodéficience humaine : une série de cas de 33 patients . Infection. 2020, 48 : 681-6. 10.1007/s15010-020-01438-z
- Zhang S, Asquith B, Szydlo R, Tregoning JS, Pollock KM : Lymphopénie périphérique à cellules T dans le COVID-19 : mécanismes potentiels et impact . Immunautre Adv. 2021, 1:ltab015. 10.1093/immadv/ltab015
- Guo Z, Zhang Z, Prajapati M, Li Y : Lymphopénie causée par des infections virales et les mécanismes au-delà . Virus. 2021, 13:1876. 10.3390/v13091876
- Shen XR, Geng R, Li Q, et al. : Infection indépendante de l’ACE2 des lymphocytes T par le SRAS-CoV-2 . Cible de transduction de signal Ther. 2022, 7h83. 10.1038/s41392-022-00919-x
- Zhang Z, Zheng Y, Niu Z, et al. : La protéine de pointe du SRAS-CoV-2 dicte l’élimination des lymphocytes médiée par le syncytium . La mort cellulaire diffère. 2021, 28 : 2765-77. 10.1038/s41418-021-00782-3
- Mulligan MJ, Lyke KE, Kitchin N, et al. : Étude de phase I/II du vaccin à ARN COVID-19 BNT162b1 chez les adultes . Nature. 2020, 586 : 589-93. 10.1038/s41586-020-2639-4
- Folegatti PM, Ewer KJ, Aley PK, et al. : Sécurité et immunogénicité du vaccin ChAdOx1 nCoV-19 contre le SRAS-CoV-2 : rapport préliminaire d’un essai contrôlé randomisé de phase 1/2, en simple aveugle . Lancette. 2020, 396 : 467-78. 10.1016/S0140-6736(20)31604-4
- Hunter PR, Brainard J : Estimation de l’efficacité du vaccin Pfizer COVID-19 BNT162b2 après une dose unique. Une réanalyse d’une étude sur les résultats de la vaccination « dans le monde réel » en Israël [PREPRINT] . Medrxiv. 2021, 10.1101/2021.02.01.21250957
- Lopez Bernal J, Andrews N, Gower C, et al. : Efficacité précoce de la vaccination contre le COVID-19 avec le vaccin à ARNm BNT162b2 et le vaccin à vecteur adénoviral ChAdOx1 sur les maladies symptomatiques, les hospitalisations et la mortalité chez les personnes âgées en Angleterre [PREPRINT] . Medrxiv. 2021, 10.1101/2021.03.01.21252652
- Chiuppesi F, Zaia JA, Frankel PH, et al. : Sécurité et immunogénicité d’un vaccin COVID-19 synthétique multiantigène modifié contre le virus de la vaccine basé à Ankara (COH04S1) : un essai ouvert et randomisé de phase 1 . Microbe lancette. 2022, 3 : e252-64. 10.1016/S2666-5247(22)00027-1
- Volz A, Sutter G : Virus de la vaccine modifié Ankara : histoire, valeur dans la recherche fondamentale et perspectives actuelles pour le développement de vaccins . Adv Virus Res. 2017, 97 : 187-243. 10.1016/bs.aivir.2016.07.001
- Ménétrier-Caux C, Ray-Coquard I, Blay JY, Caux C : Lymphopénie chez les patients cancéreux et ses effets sur la réponse à l’immunothérapie : une opportunité d’association avec des cytokines ? . J Immunautre Cancer. 2019, 7h85. 10.1186/s40425-019-0549-5
- Warny M, Helby J, Nordestgaard BG, Birgens H, Bojesen SE : Lymphopénie accidentelle et mortalité : une étude de cohorte prospective . JAMC. 2020, 192 : E25-33. 10.1503/cmaj.191024
- Penn I : Immunité déprimée et développement du cancer . Détection du cancer Précédent. 1994, 18 : 241-52.
- Hernández-Ramírez RU, Shiels MS, Dubrow R, Engels EA : Risque de cancer chez les personnes infectées par le VIH aux États-Unis de 1996 à 2012 : une étude de couplage de registres basée sur la population . Lancette VIH. 2017, 4 : e495-504. 10.1016/S2352-3018(17)30125-X
- Wang CC, Silverberg MJ, Abrams DI : Tumeurs malignes non définissant le SIDA dans la population infectée par le VIH . Curr Infect Dis Rep.2014, 16:406. 10.1007/s11908-014-0406-0
- « Eyles J, Puaux AL, Wang X et al. : Les cellules tumorales se disséminent tôt, mais l’immunosurveillance limite la croissance métastatique, dans un modèle murin de mélanome » . J Clin Invest. 2010, 120 : 2030-9. 10.1172/JCI42002
- Romero I, Garrido C, Algarra I, Collado A, Garrido F, Garcia-Lora AM : Les lymphocytes T retiennent les métastases spontanées en dormance permanente . Cancer Rés. 2014, 74 : 1958-68. 10.1158/0008-5472.CAN-13-2084
- Kim R : Effets de la chirurgie et du choix anesthésique sur l’immunosuppression et la récidive du cancer . J Transl Med. 2018, 16:8. 10.1186/s12967-018-1389-7
- Gutierrez-Dalmau A, Campistol JM : Thérapie immunosuppressive et tumeur maligne chez les receveurs de greffe d’organe : une revue systématique . Drogues. 2007, 67 : 1167-98. 10.2165/00003495-200767080-00006
- Mode furtif : comment les cellules cancéreuses métastatiques échappent à la détection par le système immunitaire . (2016). Consulté le 20 avril 2022 : https://www.mskcc.org/news/stealth-mode-how-metastatic-cancer-cells-evade-detection-immune-system .
- Fleuren GJ, Arko Gorter A, Kuppen PJ : Surveillance immunitaire . Encyclopédie d’immunologie (deuxième édition). Delves PJ, Roitt IM (éd.) : Elsevier, Cambridge, Massachusetts ; 1998. 1:1243-7. 10.1006/rwei.1999.0321
- Grossman SA, Ellsworth S, Campian J, et al. : Survie chez les patients atteints de lymphopénie sévère après un traitement par radiothérapie et chimiothérapie pour des tumeurs solides nouvellement diagnostiquées . J Natl Compr Canc Netw. 2015, 13 : 1225-31. 10.6004/jnccn.2015.0151
- Yu H, Chen F, Lam KO, et al. : Déterminants potentiels de la lymphopénie radio-induite chez les patientes atteintes d’un cancer du sein en utilisant une approche d’apprentissage automatique interprétable . Immunol avant. 2022, 13:768811. 10.3389/fimmu.2022.768811
- Xie Y, Karki CB, Du D et al. : Les protéines Spike du SRAS-CoV et du SRAS-CoV-2 utilisent différents mécanismes pour se lier à l’ACE2 humain . Avant Mol Biosci. 2020, 7:591873. 10.3389/fmolb.2020.591873
- Zhang H, Penninger JM, Li Y, Zhong N, Slutsky AS : Enzyme de conversion de l’angiotensine 2 (ACE2) en tant que récepteur du SRAS-CoV-2 : mécanismes moléculaires et cible thérapeutique potentielle . Soins intensifs Med. 2020, 46 : 586-90. 10.1007/s00134-020-05985-9
- Huang Y, Yang C, Xu XF, Xu W, Liu SW : Propriétés structurelles et fonctionnelles de la protéine de pointe du SRAS-CoV-2 : développement potentiel d’un médicament antivirus pour le COVID-19 . Acta Pharmacol Sin. 2020, 41 : 1141-9. 10.1038/s41401-020-0485-4
- Suzuki YJ, Gychka SG : La protéine de pointe du SRAS-CoV-2 déclenche la signalisation cellulaire dans les cellules hôtes humaines : implications sur les conséquences possibles des vaccins contre la COVID-19 . Vaccins (Bâle). 2021, 9 : 10.3390/vaccins9010036
- Zhang W, Liu HT : Voies de signal MAPK dans la régulation de la prolifération cellulaire dans les cellules de mammifères . Cellule Rés. 2002, 12 : 9-18. 10.1038/sj.cr.7290105
- Patra T, Meyer K, Geerling L, et al. : La protéine de pointe du SRAS-CoV-2 favorise la trans-signalisation de l’IL-6 par l’activation de la signalisation du récepteur de l’angiotensine II dans les cellules épithéliales . Pathog PLoS. 2020, 16:e1009128. 10.1371/journal.ppat.1009128
- Taniguchi K, Karin M : NF-κB, inflammation, immunité et cancer : passage à l’âge adulte . Nat Rev Immunol. 2018, 18:309-24. 10.1038/nri.2017.142
- De Luca A, Maiello MR, D’Alessio A, Pergameno M, Normanno N : Les voies de signalisation RAS/RAF/MEK/ERK et PI3K/AKT : rôle dans la pathogenèse du cancer et implications pour les approches thérapeutiques . Avis d’experts sur les autres cibles. 2012, 16 Supplément 2 : S17-27. 10.1517/14728222.2011.639361
- L’initiative Ras . (2022). Consulté : 24 avril 2022 : https://www.cancer.gov/research/key-initiatives/ras .
- Braicu C, Buse M, Busuioc C, et al. : Une revue complète sur MAPK : une cible thérapeutique prometteuse dans le cancer . Cancers (Bâle). 2019, 11 : 10.3390/cancers11101618
- Dhillon AS, Hagan S, Rath O, Kolch W : Voies de signalisation MAP kinase dans le cancer . Oncogène. 2007, 26 : 3279-90. 10.1038/sj.onc.1210421
- Bryant KL, Stalnecker CA, Zeitouni D, et al. : Combinaison de l’inhibition de l’ERK et de l’autophagie comme approche thérapeutique du cancer du pancréas . Nat Med. 2019, 25:628-40. 10.1038/s41591-019-0368-8
- Hung AC, Tsai CH, Hou MF, et al. : Le dérivé synthétique du β-nitrostyrène CYT-Rx20 induit la mort des cellules du cancer du sein et l’autophagie via la voie MEK/ERK médiée par les ROS . Cancer Lett. 2016, 371 : 251-61. 10.1016/j.canlet.2015.11.035
- Kinsey CG, Camolotto SA, Boespflug AM, et al. : L’autophagie protectrice provoquée par l’inhibition de RAF→MEK→ERK suggère une stratégie de traitement pour les cancers induits par le RAS . Nat Med. 2019, 25:620-7. 10.1038/s41591-019-0367-9
- Guo YJ, Pan WW, Liu SB, Shen ZF, Xu Y, Hu LL : voie de signalisation ERK/MAPK et tumorigenèse . Exp Ther Med. 2020, 19:1997-2007. 10.3892/etm.2020.8454
- Gimple RC, Wang X : RAS : frapper au cœur des circuits oncogènes . Oncol avant. 2019, 9h965. 10.3389/fonc.2019.00965
- Semesiuk NI, Zhylchuk A, Bezdenezhnykh N, Lykhova A, Vorontsova AL, Zhylchuk VE, Kudryavets YI : Cellules tumorales disséminées et taux accru de certaines cytokines dans la moelle osseuse et le sang périphérique des patientes atteintes d’un cancer du sein comme facteurs prédictifs de la progression tumorale . Exp Oncol. 2013, 35 : 295-302.
- Meyer F, Samson E, Douville P, Duchesne T, Liu G, Bairati I : Marqueurs pronostiques sériques dans le cancer de la tête et du cou . Clin Cancer Rés. 2010, 16 : 1008-15. 10.1158/1078-0432.CCR-09-2014
- Finkel KA, Warner KA, Kerk S, et al. : L’inhibition de l’IL-6 avec MEDI5117 diminue la fraction de cellules souches du cancer de la tête et du cou et prévient la récidive tumorale . Néoplasie. 2016, 18 : 273-81. 10.1016/j.neo.2016.03.004
- Lai SC, Su YT, Chi CC, et al. : L’expression de DNMT3b/OCT4 confère une résistance au sorafénib et un mauvais pronostic du carcinome hépatocellulaire grâce à la régulation de l’IL-6/STAT3 . J Exp Clin Cancer Res. 2019, 38:474. 10.1186/s13046-019-1442-2
- Liao D, Liu Z, Wrasidlo WJ et al. : Le remodelage thérapeutique ciblé du microenvironnement tumoral améliore un vaccin à ADN HER-2 et prévient la récidive dans un modèle murin de cancer du sein . Cancer Rés. 2011, 71 : 5688-96. 10.1158/0008-5472.CAN-11-1264
- Yang J, Nie J, Ma X, Wei Y, Peng Y, Wei X : Cibler PI3K dans le cancer : mécanismes et avancées dans les essais cliniques . Cancer de Mol. 2019, 18h26. 10.1186/s12943-019-0954-x
- Shi X, Wang J, Lei Y, Cong C, Tan D, Zhou X : Progrès de la recherche sur la voie de signalisation PI3K/AKT dans le cancer gynécologique (revue) . Représentant Mol Med. 2019, 19 : 4529-35. 10.3892/mmr.2019.10121
- Zhang Q, Lu S, Li T et al. : ACE2 inhibe l’angiogenèse du cancer du sein en supprimant la voie VEGFa/VEGFR2/ERK . J Exp Clin Cancer Res. 2019, 38:173. 10.1186/s13046-019-1156-5
- Feng Y, Wan H, Liu J et al. : L’enzyme de conversion de l’angiotensine 2 dans la croissance tumorale et l’angiogenèse associée à la tumeur dans le cancer du poumon non à petites cellules . Représentant Oncol. 2010, 23 : 941-8. 10.3892/ou_00000718
- Yu C, Tang W, Wang Y et al. : La régulation négative de l’axe ACE2/Ang-(1-7)/Mas favorise les métastases du cancer du sein en améliorant l’entrée du calcium exploité en magasin . Cancer Lett. 2016, 376 : 268-77. 10.1016/j.canlet.2016.04.006
- Zhang Z, Li L, Li M, Wang X : Le récepteur ACE2 de la cellule hôte du SRAS-CoV-2 est en corrélation positive avec la réponse à l’immunothérapie et constitue un facteur de protection potentiel contre la progression du cancer . Comput Struct Biotechnol J.2020, 18:2438-44. 10.1016/j.csbj.2020.08.024
- Röltgen K, Nielsen SC, Silva O, et al. : Empreinte immunitaire, étendue de la reconnaissance des variantes et réponse du centre germinal dans l’infection et la vaccination humaines par le SRAS-CoV-2 . Cellule. 2022, 185 : 1025-1040.e14. 10.1016/j.cell.2022.01.018
- Ogata AF, Cheng CA, Desjardins M, et al. : Antigène vaccinal du coronavirus 2 du syndrome respiratoire aigu sévère circulant (SRAS-CoV-2) détecté dans le plasma des receveurs du vaccin ARNm-1273 . Clin Infect Dis. 2022, 74 : 715-8. 10.1093/cid/ciab465
- Brogna C, Cristoni S, Marino G, et al. : Détection de la protéine Spike recombinante dans le sang des individus vaccinés contre le SRAS-CoV-2 : mécanismes moléculaires possibles . Protéomique Clin Appl. 2023, 17:e2300048. 10.1002/prca.202300048
- Ogata AF, Maley AM, Wu C, et al. : Profilage en série ultra-sensible des antigènes et des anticorps du SRAS-CoV-2 dans le plasma pour comprendre la progression de la maladie chez les patients atteints de COVID-19 atteints d’une maladie grave . Clin Chem. 2020, 66 : 1562-72. 10.1093/clinchem/hvaa213
- El-Zayat SR, Sibaii H, Mannaa FA : Activation, signalisation et ciblage des récepteurs de type Toll : un aperçu . Bull Natl Res Cent. 2019, 43:187. 10.1186/s42269-019-0227-2
- Karikó K, Buckstein M, Ni H, Weissman D : Suppression de la reconnaissance de l’ARN par les récepteurs de type Toll : l’impact de la modification des nucléosides et l’origine évolutive de l’ARN . Immunité. 2005, 23 : 165-75. 10.1016/j.immuni.2005.06.008
- Freund I, Eigenbrod T, Helm M, Dalpke AH : Les modifications de l’ARN modulent l’activation des récepteurs innés de type Toll . Gènes (Bâle). 2019, 10 : 10.3390/gènes10020092
- Morais P, Adachi H, Yu YT : La contribution critique de la pseudouridine aux vaccins à ARNm contre la COVID-19 . Biol de développement de cellules avant. 2021, 9:789427. 10.3389/fcell.2021.789427
- Nance KD, Meier JL : Modifications en cas d’urgence : le rôle de la N1-méthylpseudouridine dans les vaccins COVID-19 . ACS Cent Sci. 2021, 7:748-56. 10.1021/acscentsci.1c00197
- Heinz FX, Stiasny K : Caractéristiques distinctives des vaccins COVID-19 actuels : connaissances et inconnues de la présentation de l’antigène et des modes d’action . Vaccins NPJ. 2021, 6:104. 10.1038/s41541-021-00369-6
- Föhse K, Geckin B, Zoodsma M et al. : L’impact du vaccin à ARNm BNT162b2 sur les réponses immunitaires adaptatives et innées . Clin Immunol. 2023, 255:109762. 10.1016/j.clim.2023.109762
- Schoggins JW, Wilson SJ, Panis M, Murphy MY, Jones CT, Bieniasz P, Rice CM : Une gamme diversifiée de produits géniques sont des effecteurs de la réponse antivirale à l’interféron de type I. Nature. 2011, 472 : 481-5. 10.1038/nature09907
- Murira A, Lamarre A : Réponses à l’interféron de type I : d’ami à ennemi dans la bataille contre les infections virales chroniques . Immunol avant. 2016, 7:609. 10.3389/fimmu.2016.00609
- Troubles immunitaires innés . (2022). Consulté : 28 avril 2022 : https://primaryimmune.org/about-primary-immunodeficiencies/special-disease-types/innate-immune-defects .
- Jouanguy E, Béziat V, Mogensen TH, Casanova JL, Tangye SG, Zhang SY : Erreurs innées humaines d’immunité contre les virus de l’herpès . Curr Opin Immunol. 2020, 62 : 106-22. 10.1016/j.coi.2020.01.004
- Sironi M, Peri AM, Cagliani R, et al. : Mutations TLR3 chez les patients adultes atteints du virus de l’herpès simplex et de l’encéphalite à virus varicelle-zona . J Infecter Dis. 2017, 215 : 1430-4. 10.1093/infdis/jix166
- Liang F, Glans H, Enoksson SL, Kolios AG, Loré K, Nilsson J : zona ophtalmique récurrent chez un patient présentant une nouvelle variante du récepteur Toll-like 3 liée à une capacité d’activation compromise dans les fibroblastes . J Infecter Dis. 2020, 221 : 1295-303. 10.1093/infdis/jiz229
- Katsikas Triantafyllidis K, Giannos P, Mian IT, Kyrtsonis G, Kechagias KS : Réactivation du virus varicelle-zona après la vaccination contre le COVID-19 : une revue systématique des rapports de cas . Vaccins (Bâle). 2021, 9 : 10.3390/vaccins9091013
- Psichogiou M, Samarkos M, Mikos N, Hatzakis A : Réactivation du virus varicelle-zona après vaccination contre le SRAS-CoV-2 . Vaccins (Bâle). 2021, 9 : 10.3390/vaccins9060572
- Lladó I, Fernández-Bernáldez A, Rodríguez-Jiménez P : Réactivation du virus varicelle-zona et vaccins à ARNm comme déclencheur . Rapport de cas JAAD. 2021, 15:62-3. 10.1016/j.jdcr.2021.07.011
- Iwanaga J, Fukuoka H, Fukuoka N, Yutori H, Ibaragi S, Tubbs RS : Une revue narrative et l’anatomie clinique de l’infection par le zona après la vaccination contre le COVID-19 . Clin Anat. 2022, 35:45-51. 10.1002/ca.23790
- Préta LH, Contejean A, Salvo F, Treluyer JM, Charlier C, Chouchana L : Étude d’association entre la déclaration du zona et les vaccins à ARNm COVID-19 (BNT162b2 et ARNm-1273) . Br. J Clin Pharmacol. 2022, 88 : 3529-34. 10.1111/bcp.15280
- Shafiq A, Salameh MA, Laswi I, et al. : Événements indésirables neurologiques d’origine immunitaire après la vaccination contre le COVID-19 : une revue systématique . J Clin Pharmacol. 2022, 62 : 291-303. 10.1002/jcph.2017
- Ivanova EN, Shwetar J, Devlin JC, et al. : Le vaccin à ARNm COVID-19 provoque une puissante réponse immunitaire adaptative sans l’inflammation persistante observée dans l’infection par le SRAS-CoV-2 . medRxiv. 2023, 10.1101/2021.04.20.21255677
- Lee JS, Shin EC : La réponse à l’interféron de type I dans le COVID-19 : implications pour le traitement . Nat Rev Immunol. 2020, 20 : 585-6. 10.1038/s41577-020-00429-3
- Hadjadj J, Yatim N, Barnabei L, et al. : Activité altérée de l’interféron de type I et réponses inflammatoires chez les patients atteints de forme grave de COVID-19 . Science. 2020, 369 : 718-24. 10.1126/science.abc6027
- Sui Y, Li J, Venzon DJ, Berzofsky JA : La protéine de pointe du SRAS-CoV-2 supprime l’expression de l’ACE2 et de l’interféron de type I dans les cellules primaires du lavage broncho-alvéolaire pulmonaire des macaques . Immunol avant. 2021, 12:658428. 10.3389/fimmu.2021.658428
- Quel est le lien entre le COVID-19 et le zona ? . (2023). Consulté : 5 mai 2023 : https://www.medicalnewstoday.com/articles/covid-and-shingles#relationship .
- Bhavsar A, Lonnet G, Wang C, et al. : Risque accru de zona chez les adultes de ≥50 ans diagnostiqués avec le COVID-19 aux États-Unis . Forum ouvert Infect Dis. 2022, 9:ofac118. 10.1093/ofid/ofac118
- Greene TT, Zuniga EI : Induction et épuisement de l’interféron de type I au cours d’une infection virale : cellules dendritiques plasmacytoïdes et découvertes émergentes du COVID-19 . Virus. 2021, 13 : 10.3390/v13091839
- Braunstein MJ, Kucharczyk J, Adams S : Ciblage des récepteurs de type Toll pour le traitement du cancer . Cible Oncol. 2018, 13:583-98. 10.1007/s11523-018-0589-7
- Aricò E, Castiello L, Capone I, Gabriele L, Belardelli F : Interférons de type I et cancer : une histoire en évolution exigeant de nouvelles applications cliniques . Cancers (Bâle). 2019, 11 : 10.3390/cancers11121943
- Dunn GP, Bruce AT, Sheehan KC, et al. : Une fonction critique des interférons de type I dans l’immunoédition du cancer . Nat Immunol. 2005, 6:722-9. 10.1038/ni1213
- Critchley-Thorne RJ, Simons DL, Yan N et al. : Une altération de la signalisation de l’interféron est un défaut immunitaire courant dans le cancer humain . Proc Natl Acad Sci US A. 2009, 106 : 9010-5. 10.1073/pnas.0901329106
- Zeinalzadeh E, Valerievich Yumashev A, Rahman HS, et al. : Le rôle de la voie Janus kinase/STAT3 dans les hémopathies malignes avec un accent sur l’épigénétique . Avant Genet. 2021, 12:703883. 10.3389/fgene.2021.703883
- Cao X, Liang Y, Hu Z et al. : La nouvelle génération d’IFN de type I activant les tumeurs améliore les réponses immunitaires antitumorales pour surmonter la résistance au traitement . Nat Commun. 2021, 12:5866. 10.1038/s41467-021-26112-2
- Yu R, Zhu B, Chen D : Immunité tumorale médiée par l’interféron de type I et son rôle en immunothérapie . Cell Mol Life Sci. 2022, 79:191. 10.1007/s00018-022-04219-z
- Gargan S, Ahmed S, Mahony R, et al. : Le VIH-1 favorise la dégradation des composants de la voie IFN JAK/STAT de type 1 et bloque l’induction de l’ISG antiviral . EBioMédecine. 2018, 30 : 203-16. 10.1016/j.ebiom.2018.03.006
- Sandstrom TS, Ranganath N, Angel JB : Dépréciation de la réponse à l’interféron de type I par le VIH-1 : cibles potentielles pour l’éradication du VIH . Facteur de croissance des cytokines Rév. 2017, 37 : 1-16. 10.1016/j.cytogfr.2017.04.004
- Reder AT, Feng X : Régulation aberrante de l’interféron de type I dans l’auto-immunité : directions opposées dans la SEP et le LED, façonnées par l’évolution et l’écologie corporelle . Immunol avant. 2013, 4:281. 10.3389/fimmu.2013.00281
- Harari D, Abramovich R, Kallweit N, et al. : 113 : La signalisation de l’interféron de type I est supprimée dans l’encéphalomyélite auto-immune expérimentale (EAE) : implications pour la sclérose en plaques . Cytokine. 2013, 63 : 269-70. 10.1016/j.cyto.2013.06.116
- Bosco-Lévy P, Foch C, Grelaud A, et al. : Incidence et risque de cancer chez les patients atteints de sclérose en plaques : une étude de cohorte appariée basée sur la population . Eur J Neurol. 2022, 29 : 1091-9. 10.1111/ene.15226
- Cosentino M, Marino F : L’hypothèse de pointe dans les effets indésirables induits par le vaccin : questions et réponses . Tendances Mol Med. 2022, 28 : 797-9. 10.1016/j.molmed.2022.07.009
- Rapport d’évaluation . (2021). Consulté le 11 avril 2021 : https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf .
- BNT162b2. Module 2.4. Aperçu non clinique . (2022). Consulté le 11 avril 2022 : https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M2_24_nonclinical-overview.pdf .
- Vaccin à ARNm du SRAS-CoV-2 (BNT162, PF-07302048) . (2022). Consulté : 11 avril 2022 : https://www.docdroid.net/xq0Z8B0/pfizer-report-japanese-government-pdf#page=17 .
- Zhouyi R, Hongcheng M, Saketh K, et al. : Accumulation de protéines de pointe du SRAS-CoV-2 dans l’axe crâne-méninges-cerveau : implications potentielles pour les complications neurologiques à long terme après le COVID-19 [PREPRINT] . bioRxiv. 2023, 10.1101/2023.04.04.535604
- Bansal S, Perincheri S, Fleming T, Poulson C, Tiffany B, Bremner RM, Mohanakumar T : À la pointe : les exosomes circulants avec la protéine de pointe COVID sont induits par la vaccination BNT162b2 (Pfizer-BioNTech) avant le développement d’anticorps : un nouveau mécanisme pour activation immunitaire par les vaccins à ARNm . J Immunol. 2021, 207 : 2405-10. 10.4049/jimmunol.2100637
- Xia X : Dissection détaillée et évaluation critique des vaccins à ARNm Pfizer/BioNTech et Moderna . Vaccins (Bâle). 2021, 9 : 10.3390/vaccins9070734
- Newman ZR, Young JM, Ingolia NT, Barton GM : Les différences de biais de codons et de contenu en GC contribuent à l’expression équilibrée de TLR7 et TLR9 . Proc Natl Acad Sci US A. 2016, 113 : E1362-71. 10.1073/pnas.1518976113
- Mauro VP, Chappell SA : Une analyse critique de l’optimisation des codons en thérapeutique humaine . Tendances Mol Med. 2014, 20 : 604-13. 10.1016/j.molmed.2014.09.003
- McKernan K, Kyriakopoulos AM, McCullough PA : Différences entre le vaccin et l’ARNm dérivé de la réplication du SRAS-CoV-2 : implications pour la biologie cellulaire et les maladies futures [PREPRINT] . Préimpressions OSF. 2021, 10.31219/osf.io/bcsa6
- Dutta N, Deb I, Sarzynska J, Lahiri A : Conséquences structurelles et thermodynamiques des paires de bases contenant de la pseudouridine et de la N1-méthylpseudouridine dans les duplex d’ARN [PREPRINT] . bioRxiv. 2023, 10.1101/2023.03.19.533340
- Svidritskiy E, Madireddy R, Korostelev AA : Base structurelle pour la terminaison de la traduction sur un codon d’arrêt pseudouridylé . J Mol Biol. 2016, 428 : 2228-36. 10.1016/j.jmb.2016.04.018
- « Eyler DE, Franco MK, Batool Z, et al. : La pseudouridinylation des séquences codantes de l’ARNm modifie la traduction » . Proc Natl Acad Sci US A. 2019, 116 : 23068-74. 10.1073/pnas.1821754116
- « Hagen T, Laski A, Brümmer A et al. : Les substitutions d’inosine dans l’ARN activent les G-quadruplexes latents » . J Am Chem Soc. 2021, 143 : 15120-30. 10.1021/jacs.1c05214
- Jara-Espejo M, Fleming AM, Burrows CJ : Les séquences potentielles de formation de G-quadruplex et la N(6)-méthyladénosine se colocalisent sur les sites d’épissage d’intron pré-ARNm humain . ACS Chem Biol. 2020, 15 : 1292-300. 10.1021/acschembio.0c00260
- Quante T, Otto B, Brázdová M, Kejnovská I, Deppert W, Tolstonog GV : Le mutant p53 est un cofacteur transcriptionnel qui se lie aux régions régulatrices riches en G des gènes actifs et génère une plasticité transcriptionnelle . Cycle cellulaire. 2012, 11 : 3290-303. 10.4161/cc.21646
- Lago S, Nadai M, Ruggiero E, et al. : Le promoteur inductible MDM2 se replie en quadruplexes G antiparallèles à quatre tétrades ciblables pour lutter contre le liposarcome malin . Acides nucléiques Res. 2021, 49 : 847-63. 10.1093/nar/gkaa1273
- Ozaki T, Nakagawara A : Rôle de p53 dans la mort cellulaire et les cancers humains . Cancers (Bâle). 2011, 3:994-1013. 10.3390/cancers3010994
- Fay MM, Lyon SM, Ivanov P : Les quadruplexes G d’ARN en biologie : principes et mécanismes moléculaires . J Mol Biol. 2017, 429 : 2127-47. 10.1016/j.jmb.2017.05.017
- Hou X, Zaks T, Langer R, Dong Y : Nanoparticules lipidiques pour la délivrance d’ARNm . Nat Révérend Mater. 2021, 6:1078-94. 10.1038/s41578-021-00358-0
- Schoenmaker L, Witzigmann D, Kulkarni JA, Verbeke R, Kersten G, Jiskoot W, Crommelin DJ : vaccins COVID-19 à base de nanoparticules d’ARNm-lipides : structure et stabilité . Int J Pharm. 2021, 601:120586. 10.1016/j.ijpharm.2021.120586
- Kedmi R, Ben-Arie N, Peer D : La toxicité systémique des nanoparticules lipidiques chargées positivement et le rôle du récepteur Toll-like 4 dans l’activation immunitaire . Biomatériaux. 2010, 31 : 6867-75. 10.1016/j.biomatériaux.2010.05.027
- Ndeupen S, Qin Z, Jacobsen S, Bouteau A, Estanbouli H, Igyártó BZ : Le composant nanoparticulaire lipidique de la plateforme ARNm-LNP utilisé dans les études précliniques sur les vaccins est hautement inflammatoire . iScience. 2021, 24:103479. 10.1016/j.isci.2021.103479
- Moghimi SM, Simberg D : Préoccupations pro-inflammatoires liées aux nanoparticules lipidiques . Mol Ther. 2022, 30 : 2109-10. 10.1016/j.ymthe.2022.04.011
- Sakurai F, Tachibana M, Mizuguchi H : Vaccin à base de vecteur adénovirus contre les maladies infectieuses . Médicament Metab Pharmacokinet. 2022, 42:100432. 10.1016/j.dmpk.2021.100432
- Preskorn SH : Les 5 % de la population à haut risque d’infection grave au COVID-19 sont identifiables et doivent être pris en compte lors de la réouverture de l’économie . Cabinet de psychiatrie J. 2020, 26 : 219-27. 10.1097/PRA.0000000000000475
- Ye Q, Wang B, Mao J : La pathogenèse et le traitement de la « tempête de cytokines » dans le COVID-19 . J Infecter. 2020, 80 : 607-13. 10.1016/j.jinf.2020.03.037
- Gupta A, Madhavan MV, Sehgal K et al. : Manifestations extrapulmonaires du COVID-19 . Nat Med. 2020, 26 : 1017-32. 10.1038/s41591-020-0968-3
- Chen G, Wu D, Guo W, et al. : Caractéristiques cliniques et immunologiques de la maladie à coronavirus sévère et modérée 2019 . J Clin Invest. 2020, 130 : 2620-9. 10.1172/JCI137244
- Singh N, Baby D, Rajguru JP, Patil PB, Thakkannavar SS, Pujari VB : Inflammation et cancer . Ann Afr Med. 2019, 18 : 121-6. 10.4103/aam.aam_56_18
- Coussens LM, Werb Z : Inflammation et cancer . Nature. 2002, 420 : 860-7. 10.1038/nature01322
- Mantovani A, Allavena P, Sica A, Balkwill F : Inflammation liée au cancer . Nature. 2008, 454 : 436-44. 10.1038/nature07205
- de Martel C, Franceschi S : Infections et cancer : associations établies et nouvelles hypothèses . Crit Rév Oncol Hématol. 2009, 70 : 183-94. 10.1016/j.critrevonc.2008.07.021
- Ji Z, He L, Regev A, Struhl K : Le réseau de régulation inflammatoire médié par l’action conjointe des facteurs NF-kB, STAT3 et AP-1 est impliqué dans de nombreux cancers humains . Proc Natl Acad Sci US A. 2019, 116 : 9453-62. 10.1073/pnas.1821068116
- Grivennikov SI, Greten FR, Karin M : Immunité, inflammation et cancer . Cellule. 2010, 140 : 883-99. 10.1016/j.cell.2010.01.025
- Mantovani A, Ponzetta A, Inforzato A, Jaillon S : Immunité innée, inflammation et progression tumorale : des épées à double tranchant . J Interne Méd. 2019, 285 : 524-32. 10.1111/joim.12886
- Ocana A, Nieto-Jiménez C, Pandiella A, Templeton AJ : Neutrophiles dans le cancer : rôle pronostique et stratégies thérapeutiques . Cancer de Mol. 2017, 16:137. 10.1186/s12943-017-0707-7
- Granot Z : Les neutrophiles comme cible thérapeutique dans le cancer . Immunol avant. 2019, 10h1710. 10.3389/fimmu.2019.01710
- Comment un cancer endormi se réveille et métastase . (2018). Consulté le 16 avril 2022 : https://www.cshl.edu/how-a-sleeping-cancer-awakens-and-metastasizes/ .
- Wu L, Saxena S, Awaji M, Singh RK : Neutrophiles associés aux tumeurs dans le cancer : devenir pro . Cancers (Bâle). 2019, 11 : 10.3390/cancers11040564
- Leach J, Morton JP, Sansom OJ : Neutrophiles : examen des mécanismes myéloïdes des métastases . Mol Immunol. 2019, 110 : 69-76. 10.1016/j.molimm.2017.12.013
- Rapoport BL, Steel HC, Theron AJ, Smit T, Anderson R : Rôle des neutrophiles dans la pathogenèse du cancer avancé et une réactivité altérée au traitement . Molécules. 2020, 25 : 10.3390/molécules25071618
- Papayannopoulos V : Pièges extracellulaires des neutrophiles dans l’immunité et la maladie . Nat Rev Immunol. 2018, 18 : 134-47. 10.1038/nri.2017.105
- Demkow U : Pièges extracellulaires à neutrophiles (TNE) dans l’invasion, l’évasion et les métastases du cancer . Cancers (Bâle). 2021, 13 : 10.3390/cancers13174495
- Masucci MT, Minopoli M, Del Vecchio S, Carriero MV : Le rôle émergent des pièges extracellulaires neutrophiles (NET) dans la progression tumorale et les métastases . Immunol avant. 2020, 11:1749. 10.3389/fimmu.2020.01749
- Parhiz H, Brenner JS, Patel PN, et al. : Ajoutées à une inflammation préexistante, les nanoparticules d’ARNm-lipides induisent une exacerbation de l’inflammation (IE) . Libération du contrôle J. 2022, 344 : 50-61. 10.1016/j.jconrel.2021.12.027
- Alavi M, Hamidi M : Ciblage passif et actif dans le traitement du cancer par les liposomes et les nanoparticules lipidiques . Drogue Metab Pers Ther. 2019, 34 : 10.1515/dmpt-2018-0032
- Bennie LA, McCarthy HO, Coulter JA : Administration améliorée de nanoparticules exploitant des formulations sensibles aux tumeurs . Nanotechnologie du cancer. 2018, 9h10. 10.1186/s12645-018-0044-6
- Maeda H : L’effet amélioré de perméabilité et de rétention (EPR) dans le système vasculaire tumoral : le rôle clé du ciblage macromoléculaire sélectif des tumeurs . Adv Enzyme Régul. 2001, 41 : 189-207. 10.1016/s0065-2571(00)00013-3
- Les nanoparticules lipidiques, acteurs clés du traitement du cancer . (2021). Consulté : 25 août 2022 : https://www.cas.org/resources/blog/lipid-nanoparticles-cancer-therapy .
- Hwang TL, Aljuffali IA, Hung CF, Chen CH, Fang JY : L’impact des nanoparticules lipidiques solides cationiques sur l’activation des neutrophiles humains et la formation de pièges extracellulaires neutrophiles (NET) . Chem Biol Interagir. 2015, 235 : 106-14. 10.1016/j.cbi.2015.04.011
- Acevedo-Whitehouse K, Bruno R : Risques potentiels pour la santé de la thérapie vaccinale à base d’ARNm : une hypothèse . Hypothèses médicales. 2023, 171:111015. 10.1016/j.mehy.2023.111015
- Zhang L, Richards A, Barrasa MI, Hughes SH, Young RA, Jaenisch R : L’ARN du SRAS-CoV-2 à transcription inverse peut s’intégrer dans le génome des cellules humaines en culture et peut être exprimé dans les tissus dérivés du patient . Proc Natl Acad Sci US A. 2021, 118 : 10.1073/pnas.2105968118
- Aldén M, Olofsson Falla F, Yang D, Barghouth M, Luan C, Rasmussen M, De Marinis Y : Transcription inverse intracellulaire du vaccin à ARNm Pfizer BioNTech COVID-19 BNT162b2 in vitro dans une lignée cellulaire hépatique humaine . Problèmes actuels Mol Biol. 2022, 44 : 1115-26. 10.3390/cimb44030073
- Zhang X, Zhang R, Yu J : Nouvelle compréhension du rôle pertinent de la rétrotransposition LINE-1 dans les maladies humaines et la modulation immunitaire . Biol de développement de cellules avant. 2020, 8:657. 10.3389/fcell.2020.00657
- McKerrow W, Wang X, Mendez-Dorantes C et al. : L’ expression de LINE-1 dans le cancer est en corrélation avec la mutation p53, la modification du nombre de copies et le point de contrôle de la phase S. Proc Natl Acad Sci US A. 2022, 119 : 10.1073/pnas.2115999119
- Rangasamy D, Lenka N, Ohms S, Dahlstrom JE, Blackburn AC, Board PG : L’activation du rétrotransposon LINE-1 augmente le risque de transition épithéliale-mésenchymateuse et de métastases dans le cancer épithélial . Curr Mol Med. 2015, 15 : 588-97. 10.2174/1566524015666150831130827
- Cammas A, Millevoi S : Quadruplexes G d’ARN : mécanismes émergents dans la maladie . Acides nucléiques Res. 2017, 45 : 1584-95. 10.1093/nar/gkw1280
- Kosiol N, Juranek S, Brossart P, Heine A, Paeschke K : G-quadruplexes : une cible prometteuse pour le traitement du cancer . Cancer de Mol. 2021, 20h40. 10.1186/s12943-021-01328-4
- Katapadi VK, Nambiar M, Raghavan SC : La formation potentielle de G-quadruplex au niveau des régions de rupture des translocations chromosomiques dans le cancer peut expliquer leur fragilité . Génomique. 2012, 100 : 72-80. 10.1016/j.ygeno.2012.05.008
- Hänsel-Hertsch R, Simeone A, Shea A et al. : Paysage des régions structurelles de l’ADN G-quadruplex dans le cancer du sein . Nat Genet. 2020, 52 : 878-83. 10.1038/s41588-020-0672-8
- Singh N, Bharara Singh A : La sous-unité S2 du SRAS-nCoV-2 interagit avec la protéine suppresseur de tumeur p53 et BRCA : une étude in silico . Trad Oncol. 2020, 13:100814. 10.1016/j.tranon.2020.100814
- Mantovani F, Collavin L, Del Sal G : Mutant p53 en tant que gardien de la cellule cancéreuse . La mort cellulaire diffère. 2019, 26 : 199-212. 10.1038/s41418-018-0246-9
- Brosh R, Rotter V : Quand les mutants acquièrent de nouveaux pouvoirs : des nouvelles du domaine mutant p53 . Nat Rev Cancer. 2009, 9 : 701-13. 10.1038/nrc2693
- Venkitaraman AR : Suppression du cancer par les gardiens des chromosomes, BRCA1 et BRCA2 . Science. 2014, 343 : 1470-5. 10.1126/science.1252230
- Green DR, Kroemer G : Fonctions cytoplasmiques du suppresseur de tumeur p53 . Nature. 2009, 458 : 1127-30. 10.1038/nature07986
- Henderson BR : Régulation du trafic intracellulaire BRCA1, BRCA2 et BARD1 . Essais biologiques. 2005, 27 : 884-93. 10.1002/bies.20277
- Moll UM, Ostermeyer AG, Haladay R, Winkfield B, Frazier M, Zambetti G : La séquestration cytoplasmique de la protéine p53 de type sauvage altère le point de contrôle G1 après des dommages à l’ADN . Mol Cell Biol. 1996, 16 : 1126-37. 10.1128/MCB.16.3.1126
- Rodriguez JA, Au WW, Henderson BR : Mauvaise localisation cytoplasmique de BRCA1 causée par des mutations associées au cancer dans le domaine BRCT . Cellule exp. 2004, 293 : 14-21. 10.1016/j.yexcr.2003.09.027
- Santivasi WL, Wang H, Wang T, et al. : Association entre l’expression cytosolique de BRCA1 et le risque métastatique dans le cancer du sein . F. J Cancer. 2015, 113 : 453-9. 10.1038/bjc.2015.208
- Rakha EA, El-Sheikh SE, Kandil MA, El-Sayed ME, Green AR, Ellis IO : Expression de la protéine BRCA1 dans le cancer du sein et sa signification pronostique . Hum Pathol. 2008, 39 : 857-65. 10.1016/j.humpath.2007.10.011
- Petitjean A, Achatz MI, Borresen-Dale AL, Hainaut P, Olivier M : Mutations TP53 dans les cancers humains : sélection fonctionnelle et impact sur le pronostic et l’issue du cancer . Oncogène. 2007, 26 : 2157-65. 10.1038/sj.onc.1210302
- Mutations du gène BRCA : risque de cancer et tests génétiques . (2020). Consulté : 26 avril 2022 : https://www.cancer.gov/about-cancer/causes-prevention/genetics/brca-fact-sheet .
- « Risque de cancer associé aux mutations héréditaires de BRCA1 » . (2022). Consulté : 15 avril 2022 : https://www.facingourrisk.org/info/hereditary-cancer-and-genetic-testing/hereditary-cancer-genes-and-risk/genes-by-na… .
- Mersch J, Jackson MA, Park M et al. : Cancers associés aux mutations BRCA1 et BRCA2 autres que celles du sein et de l’ovaire . Cancer. 2015, 121 : 269-75. 10.1002/cncr.29041
- Abate G, Frisoni GB, Bourdon JC, Piccirella S, Memo M, Uberti D : Le rôle pléiotrope de p53 dans les neurones fonctionnels/dysfonctionnels : focus sur la pathogenèse et le diagnostic de la maladie d’Alzheimer . Alzheimer Res Ther. 2020, 12h160. 10.1186/s13195-020-00732-0
- Szybińska A, Leśniak W : Dysfonctionnement de P53 dans les maladies neurodégénératives – cause ou effet des changements pathologiques ? . Vieillissement Dis. 2017, 8:506-18. 10.14336/AD.2016.1120
- Nakamura M, Kaneko S, Dickson DW, Kusaka H : Accumulation aberrante de BRCA1 dans la maladie d’Alzheimer et autres tauopathies . J Neuropathol Exp Neurol. 2020, 79 : 22-33. 10.1093/jnen/nlz107
- Une petite étude révèle des changements semblables à ceux de la maladie d’Alzheimer dans le cerveau de certains patients atteints de COVID . (2022). Consulté le 7 mai 2022 : https://www.cuimc.columbia.edu/news/small-study-finds-alzheimers-changes-some-covid-patients-brains .
- Réseau international pour étudier l’impact du SRAS-CoV-2 sur le comportement et la cognition . (2023). Consulté le 18 novembre 2023 : https://www.alz.org/research/for_researchers/partnerships/sars-cov2-global-brain-study .
- Wang K, Chen W, Zhang Z et al. : La protéine CD147-spike est une nouvelle voie d’infection par le SRAS-CoV-2 vers les cellules hôtes . Cible de transduction de signal Ther. 2020, 5:283. 10.1038/s41392-020-00426-x
- Behl T, Kaur I, Aleya L, et al. : Interaction protéine CD147-spike dans COVID-19 : lancez le processus avec un nouveau récepteur et une nouvelle cible thérapeutique . Sci Total Environ. 2022, 808 : 152072. 10.1016/j.scitotenv.2021.152072
- Shilts J, Crozier TW, Greenwood EJ, Lehner PJ, Wright GJ : Aucune preuve de la basigine/CD147 en tant que récepteur direct de liaison de pointe du SRAS-CoV-2 . Sci Rep.2021, 11:413. 10.1038/s41598-020-80464-1
- Xu T, Zhou M, Peng L, et al. : La régulation positive de CD147 favorise l’invasion cellulaire, la transition épithéliale-mésenchymateuse et active la voie de signalisation MAPK/ERK dans le cancer colorectal . Int J Clin Exp Pathol. 2014, 7:7432-41.
- Yang H, Chen B : CD147 dans les cancers de l’ovaire et autres . Int J Gynecol Cancer. 2013, 23 : 2-8. 10.1097/IGC.0b013e3182749139
- Landras A, Reger de Moura C, Jouenne F, Lebbe C, Menashi S, Mourah S : CD147 est une cible prometteuse de la progression tumorale et un biomarqueur pronostique . Cancers (Bâle). 2019, 11 : 10.3390/cancers11111803
- Tatar M, Wilson FA : La plus grande campagne de vaccination de l’histoire : une opportunité en or pour regrouper les interventions de santé publique . J Glob Santé. 2021, 11:03076. 10.7189/jogh.11.03076
- Traqueur de données Covid . (2023). Consulté : 10 février 2023 : https://covid.cdc.gov/covid-data-tracker/ .
- Coronavirus (COVID-19) au Royaume-Uni. Résumé simple pour l’Angleterre . (2023). Consulté le 10 février 2023 : https://coronavirus.data.gov.uk/easy_read .
- Gonçalves SO, Luz TM, Silva AM, et al. : Les fragments de pointe du SRAS-CoV-2 peuvent-ils induire une instabilité génomique et des dommages à l’ADN chez le guppy, Poecilia réticulé ? Un effet inattendu de la pandémie de COVID-19 . Sci Total Environ. 2022, 825:153988. 10.1016/j.scitotenv.2022.153988
- Agha M, Blake M, Chilleo C, Wells A, Haidar G : Réponse sous-optimale aux vaccins à ARNm COVID-19 chez les patients atteints d’hémopathies malignes . medRxiv. 2021, 10.1101/2021.04.06.21254949
- Maneikis K, Šablauskas K, Ringelevičiūtė U, et al. : Immunogénicité du vaccin à ARNm BNT162b2 COVID-19 et premiers résultats cliniques chez les patients atteints d’hémopathies malignes en Lituanie : une étude de cohorte prospective nationale . Lancet Hématol. 2021, 8 : e583-92. 10.1016/S2352-3026(21)00169-1
- Shree T, Shankar V, Lohmeyer JJ, et al. : La thérapie ciblée sur CD20 supprime la réponse des anticorps de novo à la vaccination mais épargne l’immunité préétablie . Découverte du cancer du sang. 2022, 3:95-102. 10.1158/2643-3230.BCD-21-0222
- Pich O, Muiños F, Lolkema MP, Steeghs N, Gonzalez-Perez A, Lopez-Bigas N : Les empreintes mutationnelles des thérapies contre le cancer . Nat Genet. 2019, 51 : 1732-40. 10.1038/s41588-019-0525-5
- Korompoki E, Gavriatopoulou M, Kontoyiannis DP : Les vaccins contre la COVID-19 chez les patients atteints de cancer : un ajout bienvenu, mais une optimisation est nécessaire . JAMA Oncol. 2021, 7:1113-4. 10.1001/jamaoncol.2021.1218
- Waissengrin B, Agbarya A, Safadi E, Padova H, Wolf I : sécurité à court terme du vaccin à ARNm BNT162b2 contre la COVID-19 chez les patients atteints d’un cancer traités avec des inhibiteurs de point de contrôle immunitaire . Lancette Oncol. 2021, 22:581-3. 10.1016/S1470-2045(21)00155-8
- Garreffa E, Hamad A, O’Sullivan CC, et al. : Lymphadénopathie régionale après vaccination contre le COVID-19 : revue de la littérature et considérations pour la prise en charge des patientes dans les soins du cancer du sein . Eur J Cancer. 2021, 159 : 38-51. 10.1016/j.ejca.2021.09.033
- Wolfson S, Kim E : Dépistage du cancer du sein et adénopathie axillaire à l’ère de la vaccination contre le COVID-19 . Radiologie. 2023, 306 : e222040. 10.1148/radiol.222040
- Seban RD, Richard C, Nascimento-Leite C, et al. : Le nombre absolu de lymphocytes après la vaccination contre le COVID-19 est associé aux ganglions lymphatiques hypermétaboliques induits par le vaccin sur la TEP/CT au (18)f-FDG : un objectif dans les soins du cancer du sein . J Nucl Med. 2022, 63 : 1231-8. 10.2967/jnumed.121.263082
- Özütemiz C, Potter DA, Özütemiz AÖ, Steinberger D : Lymphadénopathie après le troisième vaccin Covid-19 . Curr Probl Cancer Case Rep.2021, 4:100127. 10.1016/j.cpccr.2021.100127
- Treglia G, Cuzzocrea M, Giovanella L, Elzi L, Muoio B : Prévalence et signification des ganglions lymphatiques hypermétaboliques détectés par TEP/CT au 2-[(18)f]fdg après vaccination contre le Covid-19 : une revue systématique et une méta-analyse . Produits pharmaceutiques (Bâle). 2021, 14 : 10.3390/ph14080762
- Meo C, Palma G, Bruzzese F, Budillon A, Napoli C, de Nigris F : Rémission spontanée du cancer après COVID-19 : enseignements de la pandémie et leur pertinence pour le traitement du cancer . J Transl Med. 2023, 21:273. 10.1186/s12967-023-04110-w
- Sousa LG, McGrail DJ, Li K, et al. : Régression spontanée de la tumeur après la vaccination contre le COVID-19 . J Immunautre Cancer. 2022, 10 : 10.1136/jitc-2021-004371
- Krzyszczyk P, Acevedo A, Davidoff EJ, et al. : Le rôle croissant de la médecine de précision et personnalisée pour le traitement du cancer . Technologie (Singap World Sci). 2018, 6:79-100. 10.1142/S2339547818300020
- Les complexités du cancer expliquées pour le bénéfice du patient . (2015). Consulté : 20 avril 2022 : https://www.aacr.org/blog/2015/05/26/complexities-of-cancer-explained-for-patient-benefit/ .
- Le cancer au fil du temps . (2023). Consulté : 22 avril 2023 : https://gco.iarc.fr/overtime/en .
- Cancer . (2023). Consulté : 22 avril 2023 : https://www.aihw.gov.au/reports-data/health-conditions-disability-deaths/cancer/data .
- Statistiques du cancer au Japon ; téléchargement du tableau . (2022). Consulté : 22 avril 2023 : https://ganjoho.jp/reg_stat/statistics/data/dl/en.html .
- Statistiques d’enregistrement du cancer, Angleterre . (2019). Consulté : 22 avril 2023 : https://www.ons.gov.uk/peoplepopulationandcommunity/healthandsocialcare/conditionsanddiseases/datasets/cancerregistra… .
- Statistiques canadiennes sur le cancer . (2023). Consulté le 22 avril 2023 : https://cancer.ca/en/research/cancer-statistics/canadian-cancer-statistics .
- ECIS – Système européen d’information sur le cancer . (2022). Consulté le 22 avril 2023 : https://ecis.jrc.ec.europa.eu/explorer.php?$0-0$1-All$2-All$4-1,2$3-0$6-0,85$5-2020 ,2020$7-7$CEstByCountry$X0_8-3$X0_… .
- Henley SJ, Dowling NF, Ahmad FB, Ellington TD, Wu M, Richardson LC : COVID-19 et autres causes sous-jacentes de décès par cancer – États-Unis, janvier 2018-juillet 2022 . MMWR Morb Mortal Wkly Rep. 2022, 71 : 1583-8. 10.15585/mmwr.mm7150a3
- Schuppener LM, Olson K, Brooks EG : Certification de décès : erreurs et interventions . Clin Med Rés. 2020, 18:21-6. 10.3121/cmr.2019.1496
- Vaccins contre la COVID-19 chez les personnes atteintes de cancer . (2023). Consulté : 6 novembre 2023 : https://www.cancer.org/treatment/treatments-and-side-effects/physical-side-effects/low-blood-counts/infections/covid-… .
- Vaccins contre la COVID-19 et personnes atteintes de cancer. (2023). Consulté : 6 septembre 2023 : https://www.cancer.gov/about-cancer/coronavirus/covid-19-vaccines-people-with-cancer.
- Hwang JK, Zhang T, Wang AZ, Li Z : Vaccins contre la COVID-19 pour les patients atteints de cancer : les avantages l’emportent probablement sur les risques . J Hématol Oncol. 2021, 14h38. 10.1186/s13045-021-01046-w
- Goldman JD, Gonzalez MA, Rüthrich MM, Sharon E, von Lilienfeld-Toal M : COVID-19 et cancer : considérations particulières pour les patients recevant une immunothérapie et des thérapies anticancéreuses immunosuppressives . Am Soc Clin Oncol Educ Livre. 2022, 42 : 1-13. 10.1200/EDBK_359656
- Hassan AO, Case JB, Winkler ES, et al. : Un modèle d’infection par le SRAS-CoV-2 chez la souris démontre une protection par des anticorps neutralisants . Cellule. 2020, 182 : 744-753.e4. 10.1016/j.cell.2020.06.011
- Halma MT, Rose J, Lawrie T : La nouveauté des vaccins viraux à ARNm et leurs inconvénients potentiels : une revue de la portée . J. 2023, 6:220-35. 10.3390/j6020017
- Sutherland JV, Bailar JC 3e : Le modèle multi-impacts de la carcinogenèse : implications étiologiques pour le cancer du côlon . J Chronique Dis. 1984, 37 : 465-80. 10.1016/0021-9681(84)90030-4
- Rathnasinghe R, Strohmeier S, Amanat F et al. : Comparaison des modèles de souris transgéniques et adénovirus hACE2 pour l’infection par le SRAS-CoV-2 . bioRxiv. 2020, 10.1101/2020.07.06.190066
- Lampreht Tratar U, Horvat S, Cemazar M : Modèles de souris transgéniques dans la recherche sur le cancer . Oncol avant. 2018, 8:268. 10.3389/fonc.2018.00268
- Trivanović D, Peršurić Ž, Agaj A, Jakopović M, Samaržija M, Bitar L, Pavelić K : L’interaction du cancer du poumon, du COVID-19 et des vaccins . Int J Mol Sci. 2022, 23 : 10.3390/ijms232315067
- Carnell GW, Ciazynska KA, Wells DA, et al. : La protéine de pointe du SRAS-CoV-2 stabilisée à l’état fermé induit de puissantes réponses neutralisantes . J Virol. 2021, 95 : e0020321. 10.1128/JVI.00203-21
- Les fabricants de vaccins contre le Covid-19 regardent au-delà de la protéine Spike . (2021). Consulté : 26 avril 2023 : https://www.theatlantic.com/science/archive/2021/05/spike-protein-vaccines-covid/618954/ .
- Vaccin contre le SRAS-CoV-2 (GEO-CM04S1) versus vaccin à ARNm contre le SRAS-COV-2 chez les patients atteints d’un cancer du sang . (2023). Consulté : 26 avril 2023 : https://clinicaltrials.gov/ct2/show/NCT04977024 .
- Liu Y, Yu Q, Wen H, et al. : Ce qui compte : les interventions non pharmaceutiques pour le COVID-19 en Europe . Contrôle des infections par résistance aux antimicrobiens. 2022, 11:3. 10.1186/s13756-021-01039-x

Merci pour ce long article. Je n’ai lu que la conclusion ou presque. Il y a une coquille :
« pour lesquelles un traitement efficace et efficace. un vaccin facilement déployable est nécessaire de toute urgence. »
J’aimeJ’aime
Bien vu !
J’aimeJ’aime
Les conclusions de l’article parlent du succès d’un traitement médical par ARNm ! et de petits problèmes colatéraux à règler … parce qu’en l’état actuel de la stratégie sanitaire, cette médication provoque des maladies graves.
Hautement suspectes, ces conclusions. Et pire ! dans la manipulation des esprits lorsque mon instinct m’alerte que ces conclusions auraient été rédigées par IA, bref ! par un coup-fourré de Chat-j’ai-pêté v.4
Un indice : évoquer « Primum non nocere », pour oser parler du succès de la vax par ARNm … qu’il faudrait toutefois améliorer. C’est complètement dingue.
J’aimeJ’aime
C’est le pot-aux-roses, cet article !
Le détail, le cœur de l’article semble démontrer que les ravages de l’ARNm sont avérés, mais les conclusions en établissent un succès. Avec une recommandation pour en améliorer la technique.
Imaginons que ce recueil soit présenté à un conseiller en Santé publique – un diplômé de l’Ena -, ledit conseiller dira au PM – diplômé de Sciences-Po amélioré – : – « Regardez, Sire, vous pourrez dire au Président de la Raie publique que toutes les études démontrent le bien-fondé de la vax : c’est un succès » !
Même technique dévoiement de la Science qu’auprès du Giec … Un détournement, un dévoiement des preuves dans un but criminel …
J’aimeJ’aime
Considérant qu’un Conseiller politique en Santé publique, n’ayant aucune capacité intellectuelle de comprendre voire de lire ces études, n’en lira que les conclusions biaisées, délibérément mensongères, pour asseoir son jugement pertinent … prétendument pertinent.
Stratégie machiavélique dans la perversion des consciences ! pour les rendre complices d’un méfait, et à leur insu.
J’aimeJ’aime
Pour apprécier – mieux encore – comment les conclusions de l’article sont frauduleuses, lisons l’article de Robert Malone (en anglais-us) qui décortique la nouvelle manipulation qu’opère l’Oms davosienne et killbillienne sur la Santé des Peuples :
https://rwmalonemd.substack.com/p/disease-x-and-fear-mongering
J’aimeJ’aime
Je trouve que le chapeau de l’article de notre ami Patrice n’est pas vraiment en ligne avec la conclusion qui, finalement, encourage à déployer la technologie ARNm, après avoir résolu la cancérogénicité, ce qui semble envisagé comme une simple formalité. C’est hallucinant car après avoir lu Alexandra, on a le sentiment qu’aucune thérapie ARNm n’a, à ce jour, fonctionné.
Personnellement, je leur dis : votre thérapie, vous pouvez vous la carrer…
J’aimeJ’aime
Considérant qu’un Conseiller politique en stratégie de Santé publique n’a aucune compétence pour comprendre voire lire ! ces études qui établissent l’extrême dangerosité de l’ARNm, il n’en lira que les conclusions biaisées, délibérément mensongères, pour asseoir son jugement pertinent … prétendument pertinent.
C’est une stratégie machiavélique dans la perversion des consciences – aujourd’hui très commune – pour asservir comme complices d’un méfait les Décideurs politiques, et les posséder complices même à leur insu.
J’aimeJ’aime
A condition qu’y croyant tellement fort, ils s’injectent en premier ces saloperies !
Au final ça devrait éventuellement assainir le parc de politicards véreux !
J’aimeJ’aime
Cher Patrice Gibertie, je ne sais pas d’où vous avez déniché cette compilation de plusieurs centaines d’études qui attesteraient de la dangerosité de la vax. Or du contraire, par celles qui certifient que 3 à 4 mille Américains meurent encore du Covid … aujourd’hui ! Et, que la vax Moderna/Pfizer a un effet formidable ! auprès des Individus fragiles.
Mais, le plus intriguant demeurent les conclusions : je n’ose croire que vous les avez rédigées.
Ainsi, à l’avenir, daignez posez votre certification personnelle d’avoir lu et compris ce que vous relayez ici. Afin que nul doute …
J’aimeJ’aime
Bon je me suis farci la relecture x fois pour bien en comprendre le sens…
Et ma conclusion et la suivante: Etude de synthèse à mettre en partie à la … poubelle !
A cause de son interprétation concernant les injections Covid.
90% du texte pour décrire les problèmes d’oncogénèse ou d’interactions.
Selon ces clowns les produits style Pfizer et Moderna seraient une réussite, mais…
« Précisément, le succès des nouveaux vaccins à base d’ARNm contre le COVID-19 a suscité un intérêt généralisé pour la technologie de l’ARNm comme solution à certaines des maladies infectieuses les plus mortelles (c’est-à-dire le paludisme, la tuberculose et le VIH/SIDA) pour lesquelles un traitement efficace et efficace. un vaccin facilement déployable est nécessaire de toute urgence. »
Bon en même temps (désolé, ça me reprend… !), quand on regarde les 1ères « références » à propos du « succès » de ces produits, on a droit en priorité à des « estimations » ou des modélisations, viennent ensuite quelques études dont il faudrait analyser les biais, histoire de voir un peu mieux. mais visiblement y’a pas que du tout bon, sinon la suite aurait été ..inutile !
« Cependant, étant donné que certains des mécanismes pro-oncogènes décrits sont indépendants de l’antigène, les problèmes de sécurité actuels doivent être rapidement résolus avant que les nanomédicaments à base d’ARNm ne transforment davantage la manière dont les maladies sont gérées et prévenues à l’avenir. »
Tiens donc, y aurait-il quelques « problèmes » d’oncogénécité non résolus ?
Alors messieurs, c’est une réponse de normand ça ! P’tet ben qu’oui, p’tet ben qu’non !
Bon perso je garde ça sous le coude, trop complexe pour être survolé, plus de 250 références et étude de synthèse à lire en détail, voire à disséquer.
Bref, synthèse de la synthèse à faire !
J’aimeJ’aime
Bon tout est bien dans l’article, car en fait c’est juste un article de synthèse rédigé par deux « je ne sais encore quoi »; mais:

-1- La 1ère est apparemment inscrite au service Neurologie de l’Université de Portland mais j’ai pas encore pu voir ce qu’elle y faisait ni qui finançait ! On peut néanmoins voir sur le site tout un ensemble de pages dédié à « la diversité et l’inclusion » (j’ai traduit bien sûr) ! La photo adjacente est là pour bien marquer les esprits pour ceux qui n’auraient pas compris !
– 2- la seconde est en Espagne à Barcelone… à ce qui s’appelle « département de l’éducation » à priori.
Voici les « missions » de cette branche:
https://web.gencat.cat/ca/adreces-i-telefons/detall/index.html?codInf=1599
En résumé, ces 2 rédactrices semblent nous la jouer formatage d’esprit, sans même parler d’éventuels liens de financement.
La 1ère semble être un Docteur en Pharmacie rattachée au pôle neurologie de l’Université mais rien sur son activité à part sa participation à une 20taine de séminaire dont 1 seul qu’elle aurait animé en 04/2023: « »The mystery of East Africa’s Nodding syndrome ».
Pour la seconde j’ai rien à part une homonyme ayant travaillé au Museum d’Histoire Naturelle de… Los Angeles !! Mais quand on liste les fonctions du service à Barcelone….
Enfin j’ai aussi récupéré le preprint de 09/2023, ici:
https://www.authorea.com/users/508862/articles/586489-navigating-uncharted-waters-could-covid-19-and-or-certain-covid-19-vaccines-promote-malignancy
A noter que McCullough semble sur X dire du bien de cet article.
Conclusion:
Mise à part un certaine transpiration de crédulité quant à la performance pure de la plateforme ARNm, il y a bien de nombreuses critiques au grand jour. Mais il est impossible en l’état sur ce type d’article de se faire une opinion simple tant les sources mentionnées font le grand écart entre vraies études pas frelatées et… estimations de tous bords allègrement bidonnées.
Une chose est sûre c’est que la conclusion de l’article de notre blog favori fait bien partie de l’article d’origine. A l’erreur près de traduction (2 fois le mot efficace).
La traduction correcte serait de « for which an effective and easily deployable vaccine is urgently needed » pourrait être « pour lesquelles (les infections citées) un vaccin efficace et facilement déployable est (serait ?) nécessaire rapidement »
Bref, on est quand même loin de l’enthousiame !
J’aimeAimé par 1 personne
Dernière info à prendre en considération cet article:
https://www.trialsitenews.com/a/do-covid-19-vaccines-link-to-oncogenesis-34-reviewers-accept-but-frontiers-in-oncology-reject-manuscript-55bc7a4e
Et The Epoch Times a publié l’article peer reviewed le 23/12/2023, on a un peu de retard !
J’aimeJ’aime
Liste des publications de la première des rédactrices citées:
https://www.researchgate.net/scientific-contributions/Raquel-Valdes-Angues-2143876291
J’aimeJ’aime
Bonjour Lepiaf,
je me retire du blog de PG.
Ravi de vous y avoir croisé !
J’aimeJ’aime
Peut-on savoir quelle est la raison de ce « retrait » ?
Et je suis également ravi d’avoir pu échanger avec vous.
PS un de mes posts est en « validation » et curieusement ne réapparaît pas, alors que les 2 autres sont « passés ».
Pourtant les quelques liens qu’il comportait ne sont que des liens « officiels ».
C’est quand même un peu bizarre voire anormal ce comportement allant clairement vers la censure !
M. Gibertie, vous auriez une réponse, SVP ? C’est quand même pas difficile de vérifier que le nom de domaine d’un site a bien « pignon sur rue », non ?
Qui gouverne sur ce blog?
J’aimeJ’aime
Après quelque méditation fort logique, je puis également vous instruire du trouble qui perturbe la gestion de votre blog sous le module WordPress. Si toutefois ceci vous intéressait, je pourrais vous en instruire par MP. Cordialement, J 113
J’aimeJ’aime